
���� ��1�����ݸ�˹���ɽ�������ѧ����ʽ���д�����Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-24.8kJ/mol ��
3Fe2O3��s��+CO��g��=2Fe3O4��s��+CO2��g����H=-47.2kJ/mol ��
Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=+640.5kJ/mol ��
�١�3-��-�ۡ�2�õ�CO���廹ԭFeO����õ�Fe �����CO2������Ȼ�ѧ��Ӧ����ʽ��
��2�����ݳ���ת��ԭ�����бȽϸ�4�����������ܽ�ȴ�С����Ӧ����������ܵķ�Ӧ������У�
��3�����ݵ����غ㼰���ԭ���������и����ʵ��ʱ�����ֱ���������弰�������ʵ�����ϵ��
��� �⣺��1��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=-24.8kJ/mol ��
3Fe2O3��s��+CO��g��=2Fe3O4��s��+CO2��g����H=-47.2kJ/mol ��
Fe3O4��s��+CO��g��=3FeO��s��+CO2��g����H=+640.5kJ/mol ��
�١�3-��-�ۡ�2��6CO��g��+6FeO��s��=6Fe��s��+6CO2��g����H=��-24.8kJ/mol����3-��-47.2kJ/mol��-��+640.5kJ/mol����2=-1308.0kJ/mol��
�� CO��g��+FeO��s��=Fe��s��+CO2��g����H=-218.0kJ/mol
�ʴ�Ϊ��CO��g��+FeO��s��=Fe��s��+CO2��g����H=-218.0kJ/mol��
��2�����ݳ���ת��ԭ�����ܽ��С����ת��Ϊ�ܽ�ȸ�С�ģ�����4�����������ܽ�ȼ�С��˳���ǣ�AgCl��AgBr��AgI��Ag2S��
�ʴ�Ϊ��AgCl��AgBr��AgI��Ag2S��
��3����̼�����缫���������ˮ��Һ��������ͬ��˵��ת�Ƶĵ��ӵ����ʵ�����ȣ�����nmol����ת�ƣ�
�ٵ��Na2SO4��Һ��ʵ��Ϊ���ˮ��������������0.25nmol��������������0.5nmol��
�ڸ���AgNO3��Һ��������������0.25nmol���������ɽ�����nmol��
�۸���KCl��Һ��������������0.5nmol��������������0.5nmol
�ܸ���CuCl2��Һ��������������0.5nmol���������ɽ���ͭ0.5nmol��
A���������Ϸ�����֪��ͨ����ͬ����ʱ��������������������ʵ�����ͬ���ǣ��٢ۣ��ʴ�Ϊ���٢ۣ�
B��ͨ����ͬ����ʱ�������������ܵ����ʵ����ɶൽ������˳���ǣ��ۣ��٣��ܣ��ڣ��ʴ�Ϊ���ۣ��٣��ܣ��ڣ�
���� ���⿼�鷴Ӧ�ȵļ��㣬����ˮ���ԭ����Ӧ�á����ܵ���ʵij���ת�������յ��ԭ�����ܹ���ȷ�жϵ������Һ�з����ĵ缫��Ӧ����Ŀ�Ѷ��еȣ�ע�ػ���֪ʶ�Ŀ��飮


 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
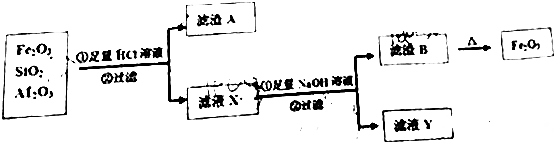
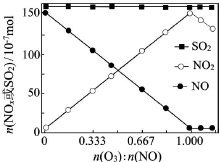 ��������Ҫ��Ⱦ��SO2��NOx����O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ���������SO2��NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ��
��������Ҫ��Ⱦ��SO2��NOx����O3Ԥ��������CaSO3ˮ����Һ���գ��ɼ���������SO2��NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
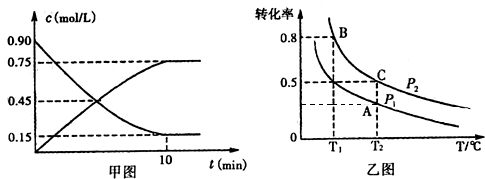
| NH3•H2O | H2SO3 | ||
| ����ƽ�ⳣ����mol/L�� | 1.7��10-5 | Ka1 | Ka2 |
| 1.54��10-2 | 1.02��10-7 | ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2N2H4��g��+N2O4��g���T3N2��g��+4H2O��g����H=-1076.7 kJ/mol | |
| B�� | N2H4��g��+$\frac{1}{2}$N2O4��g���T$\frac{3}{2}$N2��g��+2H2O��g����H=-542.7 kJ/mol | |
| C�� | 2N2H4��g��+N2O4��g���T3N2��g��+4H2O��g����H=-542.7 kJ/mol | |
| D�� | 2N2H4��g��+N2O4��g���T3N2��g��+4H2O��l����H=-1059.3 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6 g̼��ȫȼ��ʱ�ų�����196.8 kJ | |
| B�� | CO��ȼ���ȡ�H=-283.0 kJ/mol | |
| C�� | H2��ȼ���ȡ�H=-241.8 kJ/mol | |
| D�� | �Ʊ�ˮú���ķ�Ӧ�ȡ�H=+131.3 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
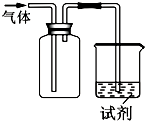 ��ͼװ�ÿ������ռ����岢��֤�仯ѧ���ʣ����ж�Ӧ��ϵ��ȫ��ȷ���ǣ�������
��ͼװ�ÿ������ռ����岢��֤�仯ѧ���ʣ����ж�Ӧ��ϵ��ȫ��ȷ���ǣ�������| ѡ�� | ���� | �Լ� | ���� | ���� |
| A | NO | ��ɫʯ����Һ | ��Һ��� | NO��ˮ��Ӧ�������� |
| B | Cl2 | KI������Һ | ��Һ���� | Cl2�������� |
| C | SO2 | ����KMnO4��Һ | ��Һ��ɫ | SO2��Ư���� |
| D | NH3 | ��̪�Լ� | ��Һ��� | NH3�м��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com