
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2+2CH3OH―→CO(OCH3)2+H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。
计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量。
 (1)已知25 ℃时,甲醇和DMC的标准燃烧热分别为ΔH1和ΔH2,则上述反应在25 ℃时的焓变ΔH3=________。
(1)已知25 ℃时,甲醇和DMC的标准燃烧热分别为ΔH1和ΔH2,则上述反应在25 ℃时的焓变ΔH3=________。
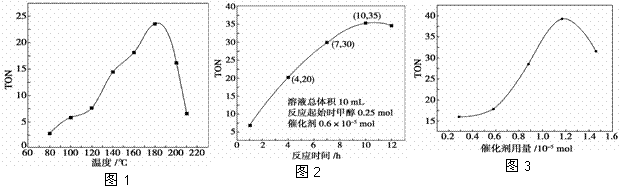
(2)根据反应温度对TON的影响图(图1)判断该反应的焓变ΔH________0(填“>”、“=”或“<”),理由是_________________。
(3)根据反应时间对TON的影响图(图2),已知溶液总体积 10 mL,反应起始时甲醇0.25 mol,催化剂0.6×10-5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量TON的影响图(图3),判断下列说法正确的是________。
a.由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b.在反应体系中添加合适的脱水剂,将提高该反应的TON
c.当催化剂用量低于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d.当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式
N2 + 3H2 = 2NH3 ΔH=—92.4 KJ/mol,则N≡N键的键能是 ( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑+ 4H2O
⑴用双线桥法分析上述反应(只需标出电子得失的方向和数目)
⑵上述反应中氧化剂是  ,氧化产物是 。硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的 。
,氧化产物是 。硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气,或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁,对它们的冶炼方法的分析不正确的是( )
A.(Ⅰ)用① B.(Ⅱ)用② C.(Ⅲ)用③ D. (Ⅳ)用④
(Ⅳ)用④
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O =HClO+ HSO3-
D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:
2Al3++3SO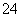 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2HI(g) I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是( )
I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是( )
A.各组分的物质的量 B.混合物的温度 C.容器内压强 D.混合气体的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,某反应的化学方程式为:CO2+NO  NO2+CO ,下列说法正确的是( )
NO2+CO ,下列说法正确的是( )
A.升高温度,正反应速率增大,逆反应速率减少
B.恒温时,压缩容器的体积,颜色加深,因平衡左移
C.达到平衡,其平衡常数为
D.恒容时,升高温度,混合气体的颜色加深,该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.1molH2O中约含有6.02×1023个H B.1molCH4的体积约为22.4L
C.CO2的摩尔质量为44g D.1molNaOH质量是40g
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应①KHCO3溶液与石灰水反应;②Na2SO3溶液与稀盐酸反应;③Si与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量,不能用同一个离子方程式表示的是( )
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com