
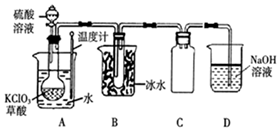
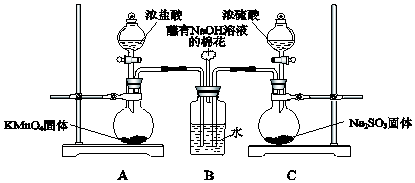
 二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)
二氧化氯(ClO2)被联合国世界卫生组织(WHO)列为AⅠ级高效安全灭菌消毒剂.常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不与水反应.温度过高,二氧化氯的水溶液可能爆炸.某研究性学习小组拟用图所示装置制取并收集ClO2.(加热和夹持装置均省略)分析 A装置由草酸、氯酸钾和硫酸制二氧化氯(ClO2):H2C2O4+2KClO3+H2SO4$\frac{\underline{\;60℃-80℃\;}}{\;}$K2SO4+2ClO2↑+2CO2↑+2H2O,B装置冷凝并收集产品ClO2,C装置防倒吸,D装置吸收多余的ClO2,防止污染空气,
(1)由草酸、氯酸钾和硫酸在60℃~80℃之间生成C1O2、CO2和硫酸钾,据此书写;
(2)根据常温下二氧化氯为黄绿色气体,温度过高,二氧化氯的水溶液可能爆炸分析;
(3)B装置收集产品二氧化氯;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为NaClO2,根据氧化还原反应规律来书写;
(5)有碘单质生成,用淀粉做指示剂;根据元素守恒结合反应得到关系式2ClO2~5I2~10Na2S2O3计算c(ClO2);
(6)检验氯离子选用酸化的硝酸银溶液,因为有硫酸根离子的干扰,故应选择钡盐排除硫酸根离子的干扰,据此分析.
解答 解:(1)由草酸、氯酸钾和硫酸在60℃~80℃之间生成C1O2、CO2和一种硫酸钾,反应为:H2C2O4+2KClO3+H2SO4$\frac{\underline{\;60℃-80℃\;}}{\;}$K2SO4+2ClO2↑+2CO2↑+2H2O;
故答案为:H2C2O4+2KClO3+H2SO4$\frac{\underline{\;60℃-80℃\;}}{\;}$K2SO4+2ClO2↑+2CO2↑+2H2O;
(2)由题可知:常温下二氧化氯为黄绿色气体,温度过高,二氧化氯的水溶液可能爆炸,则圆底烧瓶中可以观察到有气泡逸出,并产生黄绿色气体,温度计的作用是控制温度,避免温度过高引起爆炸;
故答案为:控制温度,避免温度过高引起爆炸;溶液中有气泡逸出,圆底烧瓶内产生黄绿色气体;
(3)二氧化氯熔沸点较低,在冰水中冷凝并收集;
故答案为:将C1O2冷凝并收集;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为NaClO2,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为NaClO3;
故答案为:NaClO3;
(5)有碘单质生成,用淀粉做指示剂;二氧化硫和碘单质的反应中,根据电子守恒,得到:2ClO2~5I2,结合反应2Na2S2O3+I2=Na2S4O6+2NaI,得到关系式:2ClO2~5I2~10Na2S2O3.
设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{1{0}^{-2}×x×{V}_{1}×1{0}^{-3}}{1{0}^{-1}}$1×10-3cV2mol
x=$\frac{2c{V}_{2}}{{V}_{1}}$mol/L=$\frac{135c{V}_{2}}{{V}_{1}}$g/L;
故答案为:淀粉溶液;$\frac{135c{V}_{2}}{{V}_{1}}$;
(6)检验氯离子选用酸化的硝酸银溶液,因为有硫酸根离子的干扰,故应选择钡盐(硝酸钡)排除硫酸根离子的干扰,再进行检验,方法为:取少量A装置反应后的溶液于试管中,加入足量Ba(NO3)2溶液,充分反应后静置,取上层清液于试管中,加入硝酸酸化的硝酸银溶液,观察是否有白色沉淀产生.若有,则存在Cl-;若无,则不存在Cl-;
故答案为:取少量A装置反应后的溶液于试管中,加入足量Ba(NO3)2溶液,充分反应后静置,取上层清液于试管中,加入硝酸酸化的硝酸银溶液,观察是否有白色沉淀产生.若有,则存在Cl-;若无,则不存在Cl-.
点评 本题考查制备实验的设计,需要把握住流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品来解决,要将教材所学到的基本知识应用到实际解决问题中去,要求基础知识掌握牢固,同时又能将基础知识应用实际应用中.


科目:高中化学 来源: 题型:填空题
 →
→
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

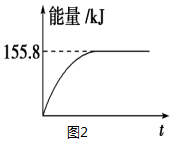
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molCO、2mol H2 | 1mol CH3OH | 2mol CO、4mol H2 |
| CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 平衡常数 | K1 | K2 | K3 |
| 反应物转化率 | α1 | α2 | α3 |
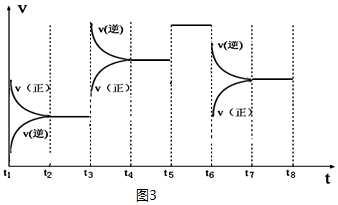
| t2~t3 | t4~t5 | t5~t6 | t7~t8 |
| K4 | K5 | K6 | K7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
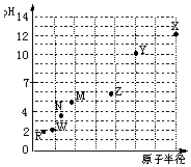 同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
同一短周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )| A. | 气态氢化物的稳定性:M>N | |
| B. | Z的最高价氧化物能溶于稀氨水 | |
| C. | X和W形成的常见化合物中阴、阳离子个数比为2:1 | |
| D. | Z和R的简单离子半径:Z3+<R- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:K>Cl>Na | B. | 热稳定性:HF>H2O>PH3 | ||
| C. | 酸性强弱:HClO4>H2SO4>H3PO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b)-58.7 | I2-184.0 |
| ③ | (e)-19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O-100.0 | H2S-60.0 | (d)-42 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
| A. | a、b、c的化学式分别为Ne2、Br2、HF | |
| B. | 第②组物质均有氧化性;第③组物质对应水溶液均是强酸 | |
| C. | 第④组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te | |
| D. | 上表中同族物质对应的氢化物的沸点,均随相对分子质量的增大而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g由14C2H2和C18O组成的混合气体中含有的质子数为14NA | |
| B. | 1 mol H2与1 mol I2 (g)混合后充分反应生成的HI分子数为2NA | |
| C. | 1 mol乙醇经催化氧化生成乙醛后转移的电子数为4NA | |
| D. | 25℃时,100 mL pH=2的新制氯水中:N(OH-)+N(ClO-)+N(HClO)=0.001NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
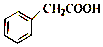 环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )
环扁桃酸酯是治疗心脑血管疾病的有效药物.苯乙酸是合成环扁桃酸酯的重要中间体,其结构简式如图,下列关于苯乙酸的说法错误的是( )| A. | 与苯甲酸互为同系物 | |
| B. | 有6种含酯基的芳香化合物与其互为同分异构体 | |
| C. | 能发生取代反应和加成反应 | |
| D. | 与CH3CH2OH所生成酯的分子式为C10H14O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com