
 CH3OH(g)�����������仯����ͼ�����ߢ��ʾʹ�ô���ʱ�������仯����Ͷ��a mol CO��2a mol H2��ƽ��ʱ������0.1a mol CH3OH����Ӧ�;߹�ҵӦ�ü�ֵ��
CH3OH(g)�����������仯����ͼ�����ߢ��ʾʹ�ô���ʱ�������仯����Ͷ��a mol CO��2a mol H2��ƽ��ʱ������0.1a mol CH3OH����Ӧ�;߹�ҵӦ�ü�ֵ��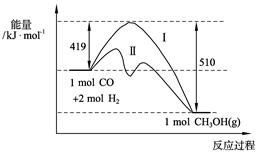
 CH3OH(g) ��H>��91 kJ��mol��1
CH3OH(g) ��H>��91 kJ��mol��1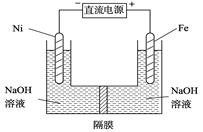
 ��
��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
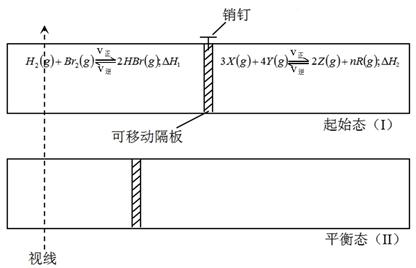
| �� �� | H2 | Br2��g�� | HBr | X | Y | Z | R |
| ���ʵ�����mol�� | 2��0 | 2��0 | 5��0 | ��x | 8��0 | 0��50 | 1��5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 3C��g����2D��g����
3C��g����2D��g����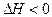 ��4min��������ڵķ�Ӧ�ﵽƽ�⣬A��Ũ��Ϊ2.4mol/L��B��Ũ��Ϊ1.8mol/L��t min���������ڵķ�Ӧ�ﵽƽ�⣬B��Ũ��Ϊ0.8mol/L�������������Ϣ�ش��������⣺
��4min��������ڵķ�Ӧ�ﵽƽ�⣬A��Ũ��Ϊ2.4mol/L��B��Ũ��Ϊ1.8mol/L��t min���������ڵķ�Ӧ�ﵽƽ�⣬B��Ũ��Ϊ0.8mol/L�������������Ϣ�ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
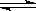 4C+6D���ﵽƽ��ʱ�����A��ת���ʴ���B��ת���ʡ���n��ȡֵ��Χ��ȷ����
4C+6D���ﵽƽ��ʱ�����A��ת���ʴ���B��ת���ʡ���n��ȡֵ��Χ��ȷ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
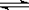 x C(g)��2minʱ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��ʣ��1.8molB�������C��Ũ��Ϊ0.4mol/L������д���пհף�
x C(g)��2minʱ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��ʣ��1.8molB�������C��Ũ��Ϊ0.4mol/L������д���пհף��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)�������������ܱ������ﵽ��ѧƽ�����
2C(g)�������������ܱ������ﵽ��ѧƽ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
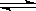 2SO3(g)����H<0�����н�������ȷ����
2SO3(g)����H<0�����н�������ȷ����| A�����¶Ȳ��䣬���������������һ������ʱ��SO2Ũ�ȱ�Ϊԭ����0.48�� |
| B����ƽ��ʱSO2��O2��ת������ȣ�˵����Ӧ��ʼʱ�����ߵ����ʵ���֮��Ϊ2:1 |
| C������ƽ����ϵ�з����SO3�������������SO2��ת���ʺͼӿ�����Ӧ���� |
| D��ƽ��״̬ʱSO2��O2��SO3�����ʵ���֮��һ��Ϊ2:1:2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
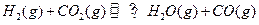 ��ƽ�ⳣ��
��ƽ�ⳣ��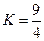 �����¶����ڼס��ҡ������������ܱ������У�
�����¶����ڼס��ҡ������������ܱ������У�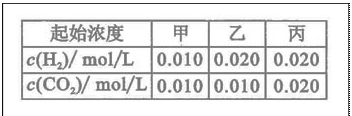
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
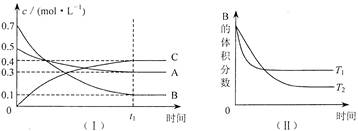
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com