
关于如图所示各装置的叙述中,正确的是( )
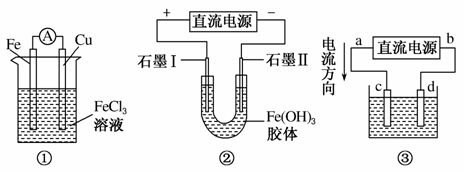
A.装置①是原电池,总反应是Cu+2Fe3+===Cu2++2Fe2+
B.装置①中,铁作负极,负极反应式为Fe3++e-===Fe2+
C.装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D.若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S) PH3(g) + HI(g) ① ;
4PH3(g) P4(g)+ 6 H2(g) ② ;
2HI(g) H2(g) + I2(g) ③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴ 平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)= ,n(PH3)= 。
⑵ a,b,c三者的关系服从a > (填含b,c的代数式)。
⑶ 平衡后,增大压强,容器内n(I2) , n(PH4I) (增加、减少、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
A.向NaOH溶液中加入少量Mg(HCO3)2溶液:2OH-+Mg2+===M g(OH)2↓
g(OH)2↓
B.向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液:HCO +Ba2++H++SO
+Ba2++H++SO ===BaSO4↓+H2O+CO2↑
===BaSO4↓+H2O+CO2↑
C.酸性KMnO4溶液与H2O2反应:2MnO +10H++3H
+10H++3H 2O2===2Mn2++3O2↑+8H2O
2O2===2Mn2++3O2↑+8H2O
D.向Fe(NO3)3溶液中加入过量HI溶液:Fe3++3NO +12H++10I-===Fe2++3NO↑+5I2+6H2O
+12H++10I-===Fe2++3NO↑+5I2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染。已知CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,CH4(g)+4NO(g)===2N2 (g)+CO2(g)+2H2O(g)
(g)+CO2(g)+2H2O(g)
ΔH=-1 160 kJ·mol-1。若在标准状况下4.48 L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
A.114.8 kJ B.232 kJ
C.368.8 kJ D.173.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
铅蓄电池反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法正确的是( )
2PbSO4(s)+2H2O(l),下列说法正确的是( )
A.放电时,负极的电极反应式为:Pb-2e-===Pb2+
B.放电时 ,正极得电子的物质是PbO2
,正极得电子的物质是PbO2
C.充电时,电解质溶液中硫酸浓度减小
D.充电时,阴极的电极反应式为PbSO4-2e-+2H2O===PbO2+4H++SO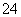
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回 答相关问题:
答相关问题:
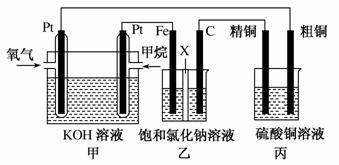
(1)甲烷燃料电池负极反应式是______________________ __________________________________________________。
(2)石墨(C)极的电极反应式为________________ __________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成的气体体积为________L;丙装置中阴极析出铜的质量为________g。
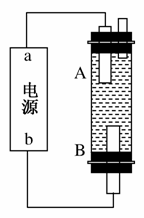
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的____极,电解质溶液最好用______。
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H22NH3实现储氢和输氢。下列说法正确的是________。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH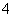 与PH
与PH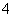 、CH4
、CH4 、BH
、BH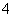 、ClO
、ClO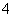 互为等电子体
互为等电子体
c.相同压强下,NH3沸点比PH3的沸点 高
高
d.[Cu(NH3)4]2+中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是________________________________________。
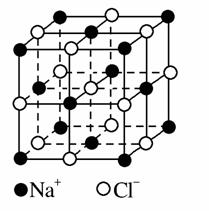
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代 表物,其晶胞结构如图所示。
表物,其晶胞结构如图所示。
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则与Na+次近邻的Cl-个数为________,该Na+与跟它次近邻的Cl-之间的距离为________。
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为________。(用含a、b的式子
表示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾(KMnO4)和过氧化氢(H2O2)是两种典型的氧化剂。
(1)H2O2的结构式为________________。
(2)下列物质中能使酸性KMnO4溶液褪色的是________(填序号)。
A.臭碱(Na2S) B.小苏打(NaHCO3)
C.水玻璃(Na2SiO3) D.酒精(C2H5OH)
(3)高锰酸钾、双氧水、活性炭常用于饮用水的处理,但三者联合作用时必须有先后顺序。
①在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-—→2H++O2↑
还原反应:MnO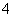 +5e-+8H+—→Mn2++4H2O
+5e-+8H+—→Mn2++4H2O
写出该氧化还原反应的离子方程式:____________________________。
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:KMnO4+C+H2O—→MnO2+X+K2CO3(未配平),其中X的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离Br2和CCl4的混合物 | 分液漏斗、烧杯 | Br2和CCl4的混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 |
|
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液的浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、 0.100 0 mol·L-1盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com