
| A. | Mg2++2OH-═Mg(OH)2↓ | B. | Mg(OH)2+2H+═2Mg2++2H2O | ||
| C. | Mg(OH)2═MgO+H2O | D. | MgCl2═Mg+Cl2↑ |
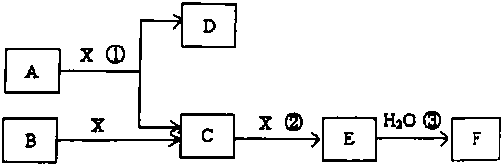
分析 从海水中提取金属镁的流程为:先将海水中含有的镁离子转化为氢氧化镁沉淀,然后将氢氧化镁溶于盐酸中得到氯化镁溶液,用氯化镁溶液制取无水氯化镁,最后利用电解熔融氯化镁的方法冶炼镁.
解答 解:从海水中提取金属镁的流程为:
先将海水中含有的镁离子转化为氢氧化镁沉淀,反应方程式为:Mg2++2OH-=Mg(OH)2↓,
然后将氢氧化镁溶于盐酸中得到氯化镁溶液,反应方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,
用氯化镁溶液在氯化氢氛围中制取无水氯化镁,活泼金属采用电解其熔融盐的方法冶炼,镁是活泼金属,所以最后利用电解熔融氯化镁的方法冶炼镁,反应方程式为MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,所以没有涉及的方程式是氢氧化镁的分解.
故选C.
点评 本题考查了物质的性质和变化,知晓从海水中提取金属镁的流程,明确物质发生的变化及物质间的反应是解本题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$lg($\frac{b}{a}$) | B. | $\frac{1}{2}$lg($\frac{a}{b}$) | C. | 14+$\frac{1}{2}$lg($\frac{a}{b}$) | D. | 14+$\frac{1}{2}$lg($\frac{b}{a}$) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期I B族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
| 键能(kJ/mol) | 熔点(K) | 沸点(K) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
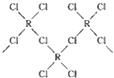 ,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$.
,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氯与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为$(CuC{l}_{3}{)_{n}}^{n-}$. ( AH3配体作为一个整体写).
( AH3配体作为一个整体写).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCl2完全溶于水时转移的电子数为NA | |
| B. | 1mol羟基(-OH)含有的电子数为9NA | |
| C. | 100g30%醋酸溶液中氢原子数为2NA | |
| D. | 100mL水中OH-的个数是10-8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g溶液中含有0.9g NaCl | B. | 100g水中含有0.9g NaCl | ||
| C. | 100g溶液中含有0.9mol NaCl | D. | 100g水中含有0.9mol NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
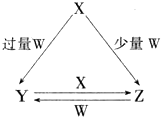 X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).
X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(水及部分产物已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com