
| A、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O→2HCO3- |
| B、FeSO4溶液在空气中变质:4Fe2++O2+2H2O→4Fe3++4OH- |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| D、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-→2CaCO3↓+Mg(OH)2↓+2H2O |


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| A、1.0mol/L |
| B、0.8mol/L |
| C、1.5mol/L |
| D、0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):
已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
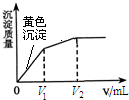 向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )
向10mL含等浓度的I-和Cl-的溶液中逐滴加入0.1mol?L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示.下列说法不正确的是( )| A、该实验可以证明AgI比AgCl更难溶 |
| B、加入V2 mL AgNO3溶液后,溶液中不含I- |
| C、V1=V2-V1 |
| D、向最终的沉淀中加入Na2S溶液,沉淀变成黑色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在Na2O、Na2O2中,阳离子和阴离子个数比分别是2:1和1:1 |
| B、常温常压下,11.2L SO2气体中含有的分子数为0.5NA |
| C、一定条件下,密闭容器充入1mol N2和3mol H2充分反应,转移电子的数目为6NA |
| D、Na2CO3溶液中,若CO32-数目为NA,则Na+数目大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
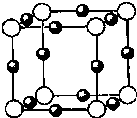 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com