
【题目】下列用来表示物质变化的化学用语中,正确的是( )
A. CO32-的水解方程式:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
D. AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32-=Al2(CO3)3↓
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
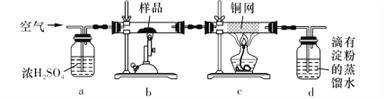
现用电子天平称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05 mol L-1标准碘溶液进行滴定,消耗标准碘溶液20. 00 mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是_____________________;标准碘溶液应盛放在___________(填“碱式”或“酸式”)滴定管中。
(2) a装置的作用是__________________(填字母代号)。
A.除去空气中的二氧化碳
B.除去空气中的水蒸气
C有利于气体混合
D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果_______________(填“偏低”“偏高”或“无影响”),写出影响测定结果的化学方程式:________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是___________________________。
(5)通过计算可知,该黄铜矿的纯度为_________________________。
(6) 假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=1的某溶液A中含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol/L,现取该溶液进行有关实验,实验结果如下图所示: 下列有关说法正确的是
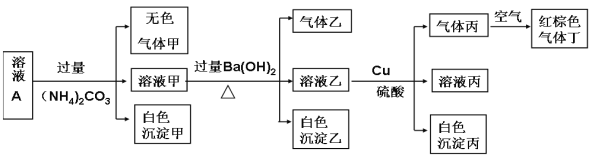
A.该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B.实验消耗Cu 14.4g,则生成气体丁的体积为3.36L
C.沉淀乙一定有BaCO3,可能有BaSO4
D.一定没有Fe3+,但是无法确定是否含有I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸铜加热分解生成CuO、O2、SO2和SO3(g)。通过测定产生的三种气体的量可确定该反应的方程式。实验用到的仪器如下图所示。

有关操作和结果如下(已知:H++HSO3-=SO2↑+H2O)。
①准确称取一定质量的无水CuSO4固体充分加热到完全分解。
②实验后测得装置F总质量比实验前减少了0.96 g(忽略水蒸气的损失和SO2的溶解)。
③干燥管C在实验后质量增加3.84 g。
④由量筒中水的体积,折算出标准状况下相应气体的体积为224 mL。
试回答下列问题:
(1)装置C的作用是__________________,装置F的作用是______________。
(2)使用上图所给仪器装置(可重复使用),按从左到右的方向连接各仪器,接口顺序为①→⑨⑩→⑥⑤→________→________→________→②(填序号) 。
(3)装置F中发生反应的化学方程式为_______________________________________。
(4)请通过计算,推断出该条件下反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl + 2H2O![]() NaOH + Cl2↑+ H2↑
NaOH + Cl2↑+ H2↑
(1)用双线桥表示出电子转移的方向和数目______________题干中反应改写成离子方程式是___________________________________
(2)电解食盐水的过程中,氧化产物是__________________________________
(3)电解食盐水要求对粗食盐水进行精制,以除去租食盐水中含有的泥沙和SO42-、Ca2+,Mg2+等杂质离子。精制时依次加入氯化钡溶液、纯碱、烧碱,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式:___________________,________________________________.
(4)实验室欲用固体NaOH来配制90ml 0.5 mol/L的NaOH溶液来用于以上除杂,需要称量固体NaOH_______g。配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为__________。在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是___________(填字母)。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中定容
C.容量瓶不干燥,含有少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物在能源和材料方面具有广泛的用途,回答下列问题:
(1)已知CH4(g)+![]() O2(g)=CO(g)+2H2O(l)
O2(g)=CO(g)+2H2O(l) ![]() =-607.31kJ/mol
=-607.31kJ/mol
2CO(g)+ O2(g)=2CO2(g) ![]() =-566.0kJ/mol
=-566.0kJ/mol
写出表示甲烷燃烧热的热化学方程式________________。
(2)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
在密闭容器中通入物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示。则:
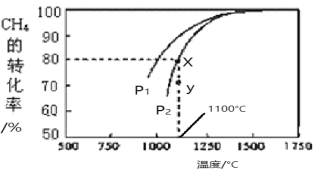
①压强P2_____P1(填 “>”或“<”);原因________________________________________________________________________________。
②压强为P1时,在Y点:v(逆)_______v(正)(填“>”、“<”或“=”)。
③求X点对应温度下的该反应的平衡常数K=____________。(计算结果保留两位小数)
(3)CO可以合成二甲醚,CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H<0,二甲醚可以作为燃料电池的原料。利用此燃料电池以石墨为电极电解1L,0.5mol/L的CuSO4溶液,导线通过0.1mol电子时,假设溶液体积不变,则所得溶液pH=______________,标况下理论上产生O2_______________L(保留小数点后两位)。
CH3OCH3(g)+H2O(g) △H<0,二甲醚可以作为燃料电池的原料。利用此燃料电池以石墨为电极电解1L,0.5mol/L的CuSO4溶液,导线通过0.1mol电子时,假设溶液体积不变,则所得溶液pH=______________,标况下理论上产生O2_______________L(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图甲所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图乙所示。则下列分析正确的是( )
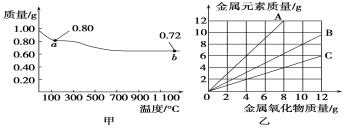
A. 图甲中a点和b点对应物质的化学式分别为Cu2O和CuO
B. 图甲整个过程中共生成0.26 g水
C. 图乙三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图甲中,a到b的过程中有0.01 mol电子发生了转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-空气电池原理模型如图所示,下列说法不正确的是

A. 电池正极可以吸附空气中氧气作为氧化剂
B. 正极反应为2Li+ + O2 + 2e- ![]() Li2O2
Li2O2
C. 电解质能传递锂离子和电子,不可以用水溶液
D. 负极反应Li - e-=Li+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com