
| A. | 氧化铝可以与氢氧化钠溶液反应 | |
| B. | 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 | |
| C. | 氯气通入石蕊中先变红后褪色 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
分析 A、氧化铝可以与氢氧化钠溶液反应,是酸性氧化物与碱反应,非氧化还原反应;
B、向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成,强酸制弱酸;
C、氯气与水反应生成HCl、HClO,HCl具有酸性,HClO具有漂白性;
D、向Fe2(SO4)3溶液中滴加NaOH溶液,复分解生成氢氧化铁.
解答 解:A、氧化铝可以与氢氧化钠溶液反应,是酸性氧化物与碱反应,非氧化还原反应,故A不选;
B、向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成,强酸制弱酸,非氧化还原反应,故B不选;
C、氯气与水反应生成HCl、HClO,HCl具有酸性,HClO具有漂白性,与氧化还原有关,故C选;
D、向Fe2(SO4)3溶液中滴加NaOH溶液,复分解生成氢氧化铁和硫酸钠,非氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应判断的考查,注意从化合价角度分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
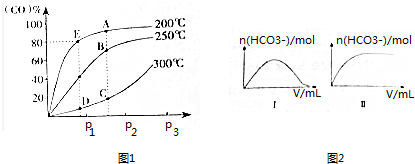
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
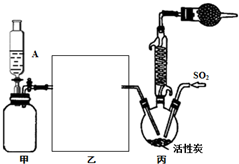 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36L SO3含有的原子数目为0.6NA | |
| B. | 1 molNa2O2与足量的水反应,转移的电子数为2NA | |
| C. | 在常温常压下,13.8克NO2与足量水充分反应,剩余气体的分子数为0.1NA | |
| D. | 在1 L lmol•L-1的氨水中,含有的NH3与NH3•H2O分子的总数等于1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有2nmol(NH4)2SO4分解 | B. | 有$\frac{n}{2}$molS原子被氧化 | ||
| C. | 生成$\frac{n}{6}$mol氧化产物 | D. | 生成7nmolH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
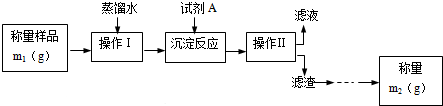
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com