
能正确表示下列化学反应的离子方程式是( )
|
| A. | 用碳酸钠溶液吸收少量二氧化硫:2CO32﹣+SO2+H2O=2HCO3﹣+SO32﹣ |
|
| B. | 金属铝溶于盐酸中:Al+2H+=Al3++H2↑ |
|
| C. | 硫化钠溶于水中:S2﹣+2H2O=H2S↑+2OH﹣ |
|
| D. | 碳酸镁溶于硝酸中:CO32﹣+2H+=H2O+CO2↑ |
| 离子方程式的书写.. | |
| 专题: | 离子反应专题. |
| 分析: | A.反应生成碳酸氢钠和亚硫酸钠; B.电子不守恒、电荷不守恒; C.水解反应为可逆反应,第一步水解生成硫氢根离子和OH﹣; D.碳酸镁不溶于水,在离子反应中应保留化学式. |
| 解答: | 解:A.用碳酸钠溶液吸收少量二氧化硫的离子反应为2CO32﹣+SO2+H2O═2HCO3﹣+SO32﹣,故A正确; B.金属铝溶于盐酸中的离子反应为2Al+6H+=2Al3++3H2↑,故B错误; C.硫化钠溶于水中的离子反应为S2﹣+H2O D.碳酸镁溶于硝酸中的离子反应为MgCO3+2H+=Mg2++H2O+CO2↑,故D错误; 故选A. |
| 点评: | 本题考查离子反应方程式的书写,明确发生的反应是解答的关键,并注意水解为可逆反应,在离子反应中应保留化学式的物质即可解答,题目难度不大. |


科目:高中化学 来源: 题型:
下列几种溶液既能检验CO2中SO2的存在,又能除去SO2的是(双选)( )
A.溴水 B.酸性KMnO4
C.饱和NaHCO3溶液 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
如图甲为氢气还原氧化铜的微型快速实验装置。实验前先将铜丝1处理成下端弯曲的小圆环,并用铁锤击成带小孔的小匙,将铜丝2一端弯曲成螺旋状。试回答下列问题:
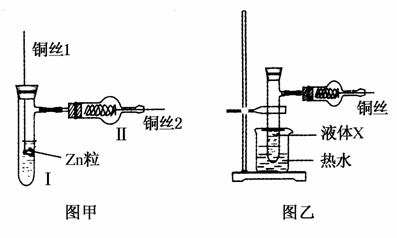
(1)在试管Ⅰ中先加入的试剂是______________________。
(2)操作铜丝2的方法是________________________________。
(3)实验现象:Ⅰ中___________________________________;Ⅱ中______________________________________________。
(4)这样处理铜丝1的优点是__________________________。这样处理铜丝2的目的是____________________________。
(5)某学生把图甲改成图乙,容器内加入有特殊香味的液体X,稍加热,铜丝的操作方法同铜丝2。若发现铜丝持续反复由黑变红,则液体可能是________,其所含官能团名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
| 甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
| 乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的 。
②萃取用到的分液漏斗使用前需 并洗净,分液时有机层在分液漏斗的 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是 ;用饱和食盐水洗涤的目的是 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 (填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先 ,再 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列叙述中正确的是( )
|
| A. | 标准状况下,2.24LCH4所含质子数为0.1NA |
|
| B. | 0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
|
| C. | 0.1mol C8H18分子中共价键总数为2.5NA |
|
| D. | 100mL 1mol/L醋酸溶液中离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
天然维生素P(结构如图)是一种营养增补剂.关于维生素P的叙述,错误的是( )
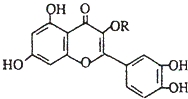
|
| A. | 可以和溴水反应 | B. | 可用有机溶剂萃取 |
|
| C. | 分子中有3个苯环 | D. | 1mol维生素P可以和4molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素性质呈周期性变化的根本原因是 ( )
A、元素的相对原子质量逐渐增大 B、核外电子排布呈周期性变化
C、核电荷数逐渐增大 D、元素化合价呈周期性变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com