



 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (2012?福建)(1)电镀时,镀件与电源的
(2012?福建)(1)电镀时,镀件与电源的查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(福建卷带解析) 题型:填空题
(16分)
(1)电镀时,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用_(填“氧化剂”或“还原剂”)与之反应。
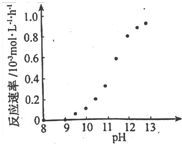
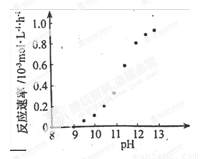
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法: 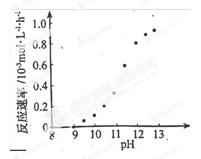
(3)酸浸法制取硫酸铜的流程示意图如下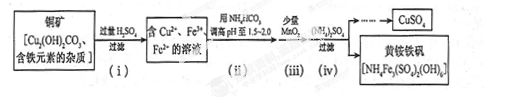
① 步骤(i)中Cu2(OH) 2CO3发生反应的化学方程式为 。
② 步骤(ii)所加试剂起调节pH 作用的离子是 (填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol MnO2转移2 mol 电子,该反应的离子方程式为 。
④ 步骤(iv)除去杂质的化学方程式可表示为
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6+6H +
过滤后母液的pH =" 2.0" , c (Fe3+) ="a" mol·L-1,, c ( NH4+)="b" mol·L-1,, c ( SO42-)=" d" mol·L-1,该反应的平衡常数K=_ (用含a 、b 、d 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第8讲 电化学基础练习卷(解析版) 题型:填空题
Ⅰ.(1)电镀时,镀件与电源的________极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成镀层。若用铜盐进行化学镀铜,应选用________(填“氧化剂”或“还原剂”)与之反应。
Ⅱ.尿素[CO(NH2)2]是首个由无机物人工合成的有机物。人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图:
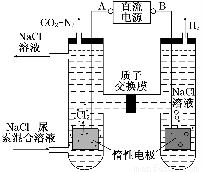
(1)电源的负极为________(填“A”或“B”)。
(2)阳极室中发生的反应依次为________、________。
(3)电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(福建卷解析版) 题型:填空题
(16分)
(1)电镀时,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉积在镀件表面形成镀层。
① 若用铜盐进行化学镀铜,应选用_(填“氧化剂”或“还原剂”)与之反应。
② 某化学镀铜的反应速率随镀液pH 变化如右图所示。该镀铜过程中,镀液pH 控制在12.5左右。据图中信息,给出使反应停止的方法:
(3)酸浸法制取硫酸铜的流程示意图如下
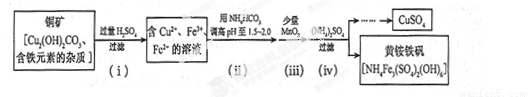
① 步骤(i)中Cu2(OH) 2CO3 发生反应的化学方程式为 。
② 步骤(ii)所加试剂起调节pH 作用的离子是 (填离子符号)。
③ 在步骤(iii)发生的反应中,1 mol MnO2转移2 mol 电子,该反应的离子方程式为 。
④ 步骤(iv)除去杂质的化学方程式可表示为
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6+6H +
过滤后母液的pH = 2.0 , c (Fe3+) =a mol·L-1,, c ( NH4+)=b mol·L-1,, c ( SO42-)= d mol·L-1,该反应的平衡常数K=_ (用含a 、b 、d 的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com