
����Ŀ��1000mlij��ɫ����Һ�г�����0.2molL��1��Na+�⣬�����ܺ������������е�һ�ֻ���֣�
������ | K+��NH4+��Fe3+��Ba2+ |
������ | Cl����CO32����HCO3����SO42�� |
�ֽ�������ʵ������������Լ���������������֪��NH4++OH����Ũ��=NH3��+H2O��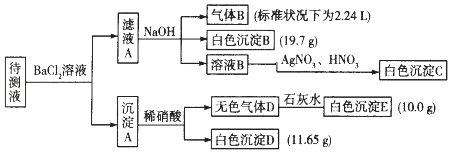
��1��ԭ��Һ�п϶����ڵ������ǣ���Na+�� �� �϶������ڵ������� ��
��2��д�����ɰ�ɫ����B�����ӷ���ʽ�� �� д������A����ϡ��������ӷ���ʽ�� ��
��3������ҺA�ͳ���A�ֿ��IJ����ǹ��ˣ�ϴ�ӣ�ϴ�ӵIJ����� ��
���𰸡�
��1��CO32����HCO3����SO42����K+��NH4+��Fe3+��Ba2+
��2��HCO3��+Ba2++OH��=BaCO3��+H2O��BaCO3+2H+=Ba2++H2O+CO2��
��3���ز�����������©���м�ˮ���պý�û��������ˮ��Ȼ���º��ظ�����2��3��
���������⣺����Һ���Ȼ�����Һ��Ӧ�õ�����A������Һ�п��ܺ���CO32����SO32����SO42�� �� ������м���ϡ�����������壬���в��ֳ������ܽ⣬����Һ�д���CO32�� �� ���ܴ���SO32����SO42���е����ֻ�һ�֣��������ӹ���֪����Һ�в�����Ba2+����ҺA����Ba2+ �� ���������NaOH��Һ�õ�����B����ɫ����B������Һ��һ������NH4+��HCO3�� �� һ��������Fe3+ �� ����BΪNH3 �� ��ɫ����BΪBaCO3 �� ��ҺB��ͨ����������dz����ɫ��Һ����Һ��һ��û��Br�� �� ��ҺB�м�����������������Һ�õ���ɫ����C��CΪAgCl��˵����ҺB�к���Cl�� �� ���ڼ����Ȼ�����Һ������ȷ��ԭ��Һ���Ƿ���Cl����
n��NH4+��=n��NH3��= ![]() =0.1mol����c��NH4+��=0.1mol/L����Һ��c��Na+��=0.2mol/L��
=0.1mol����c��NH4+��=0.1mol/L����Һ��c��Na+��=0.2mol/L��
B��̼�ᱵ�������ʵ���Ϊ ![]() =0.1mol����n��HCO3����=0.1mol����c��HCO3����=0.1mol/L��
=0.1mol����n��HCO3����=0.1mol����c��HCO3����=0.1mol/L��
E��̼��ƣ������ʵ���Ϊ ![]() =0.1mol����n��CO32����=0.1mol����c��CO32����=0.1mol/L��
=0.1mol����n��CO32����=0.1mol����c��CO32����=0.1mol/L��
D�����ᱵ�������ʵ���= ![]() =0.05mol����n��SO42����=0.05mol����c��SO42����=0.05mol/L��
=0.05mol����n��SO42����=0.05mol����c��SO42����=0.05mol/L��
c��HCO3����=0.1mol/L��c��CO32����=0.1mol/L��c��SO42����=0.05mol/L����λ���Ϊ�����=1��0.1mol/L+1��0.2mol/L=0.3mol/L����λ����ڸ����=1��0.1mol/L+2��0.1mol/L+2��0.05mol/L=0.4mol/L����λ���Ϊ����ɣ���λ����ڸ���ɣ���һ������K+ �� ����Һ��û��Cl�� �� K+����Ũ����С�����ݵ���غ��֪��c��K+����СŨ��Ϊ0.4mol/L��0.3mol/L=0.1mol/L����1��������������֪��ԭ��Һ�п϶����ڵ������ǣ���Na+��CO32����HCO3����SO42����K+��NH4+ �� ��Һ��һ��û�е��������ǣ�Fe3+��Ba2+ ��
���Դ��ǣ�CO32����HCO3����SO42����K+��NH4+��Fe3+��Ba2+����2��������������֪����ɫ����BΪ̼�ᱵ������HCO3����Ba2+��OH����Ӧ���ɣ���Ӧ���ӷ���ʽΪHCO3��+Ba2++OH��=BaCO3��+H2O������A����ϡ��������ӷ���ʽΪBaCO3+2H+=Ba2++H2O+CO2����
���Դ��ǣ�HCO3��+Ba2++OH��=BaCO3��+H2O��BaCO3+2H+=Ba2++H2O+CO2������3������ҺA�ͳ���A�ֿ��IJ����ǹ��ˣ�ϴ�ӣ�ϴ�ӵIJ������ز�����������©���м�ˮ���պý�û��������ˮ��Ȼ���º��ظ�����2��3�Σ�
���Դ��ǣ��ز�����������©���м�ˮ���պý�û��������ˮ��Ȼ���º��ظ�����2��3�Σ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����´�ʩ����ʹ���������̨��ǿ����ʴ�����������������������������������������ǣ� ��
A.�Ըֲ������������ۻ���B.ѡ�ø����Ͻ�
C.��ӵ�Դ����D.����п��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫǿ������Һ���ܴ��������һ��������
A. NH4+ ��SO42- ��Al3�� ��NO3�� B. Na+ ��K+ ��HCO3����NO3��
C. Na+ ��Ca2+ ��NO3�� ��CO32�� D. K+��Cu2+ ��NH4+ ��NO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�м�������Na2O2�����ܴ��������һ�������ǣ� ��
A.K+��AlO2����Cl����SO42��
B.Fe2+��HCO3����K2��SO42��
C.Na+��Cl����AlO2����NO3��
D.NH4+��NO3����I����CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���a molSO3����ͨ�����ΪV L���ܱ������з������·�Ӧ��2SO3=2SO2+O2 �� һ��ʱ��֮�����������������ʵ���Ϊb mol��2b��a���������ʱ���ڣ���Ӧǰ�������ѹǿ��Ϊ �� ��Ӧǰ��������ܶȱ�Ϊ �� ��Ӧ�������ƽ����Է�������Ϊ �� ��������������ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ʒ���н�ǿ�Ŀ���ʴ���ܣ���Ҫ����Ϊ
A. ����������ɫ�Ľ�������B. �������γ����ܵ������ﱡĤ
C. ������ӦD. �������ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Լ����淽��������ǣ�������
A. Ũ�����ܷⱣ��
B. ����ᱣ���ڲ���ƿ��
C. ������ˮ��������ɫ�Լ�ƿ��
D. �ռ���Һ���ô���Ƥ���IJ���ƿ��ʱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ����������������й㷺���ڣ�
��1�����Ȱ���NH2Cl���ĵ���ʽΪ �� ��ͨ����ӦNH3��g��+Cl2��g��=NH2Cl��g��+HCl��g���Ʊ��Ȱ�����֪���ֻ�ѧ���ļ������±���ʾ���ٶ���ͬ������ͬ�ֻ�ѧ���ļ���һ��������������Ӧ�ġ�H= ��
��ѧ�� | ����/��kJmol��1�� |
N��H | 391.3 |
Cl��Cl | 243.0 |
N��Cl | 191.2 |
H��Cl | 431.8 |
��NH2Cl��ˮ��Ӧ����ǿ�����Ե����ʣ�������Ч�������������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2���ý�̿��ԭNO�ķ�ӦΪ��2NO��g��+C��s��N2��g��+CO2��g�������ݻ���Ϊ1L�ļס��ҡ����������ݺ��£���Ӧ�¶ȷֱ�Ϊ400�桢400�桢T�棩�����зֱ���������Ľ�̿��һ������NO����ø�������n��NO���淴Ӧʱ��t�ı仯������±���ʾ��
t/min | 0 | 40 | 80 | 120 | 160 |
n��NO������������/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n��NO������������/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n��NO������������/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
�ٸ÷�ӦΪ������ȡ������ȡ�����Ӧ��
����������200min�ﵽƽ��״̬����0��200min����NO��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v��NO��= ��
��3���ý�̿��ԭNO2�ķ�ӦΪ��2NO2��g��+2C��s��N2��g��+2CO2��g�����ں��������£�1mol NO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ�� 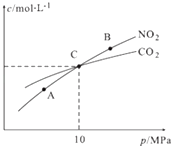
�� A��B�����Ũ��ƽ�ⳣ����ϵ��Kc��A��Kc��B���������������=������
��A��B��C������NO2��ת������ߵ������A����B����C�����㣮
�ۼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp��C��=��Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ������������еļ��֣�K+��NO![]() ��SO
��SO![]() ��NH
��NH![]() ��CO
��CO![]() ����������Һ��������H+��OH������ȡ200mL����Һ����Ϊ���ȷݽ�������ʵ�飺
����������Һ��������H+��OH������ȡ200mL����Һ����Ϊ���ȷݽ�������ʵ�飺
ʵ��1����һ�ݼ����������ռ���ȣ������������ڱ�״����Ϊ224mL��
ʵ��2���ڶ����ȼ������������ᣬ�������ټ���������BaCl2��Һ���ù���2.33g��
����˵����ȷ����
A. ����Һ�п��ܺ�K+
B. ����Һ�п϶�����NO![]() ��SO
��SO![]() ��NH
��NH![]() ��CO
��CO![]()
C. ����Һ��һ������NO![]()
D. ����Һ��һ����K+����c(K+)��0.1mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com