
| A.Li Na K Rb | B. NaF NaCl NaBr NaI |
| C.F2 Cl2 Br2 I2 | D.H2O H2S H2Se H2Te |
科目:高中化学 来源:不详 题型:单选题
| Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 920 | 801 | 1291 | 190 | -107 | 2073 | -57 | 1723 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
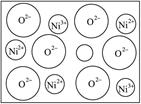
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8 | B.12 | C.24 | D.6 |
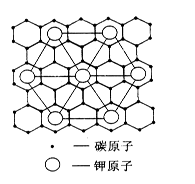
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
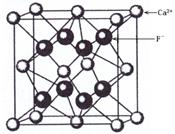
| A.一个CaF2晶胞中含有8个Ca2+ |
| B.一个CaF2晶胞中含有8个F- |
| C.在CaF2晶胞中Ca2+的配位数为4 |
| D.在CaF2晶胞中F-的配位数为8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
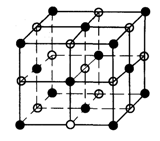
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
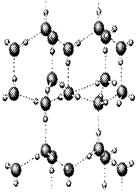
 用于估算化学反应的反应热(△H),化学反应的△H等于反应
用于估算化学反应的反应热(△H),化学反应的△H等于反应| 化学键 | F—D | F—F | B—B | F—B | C═D | D═D |
| 键能/kJ·mol-1 | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有①②⑥ | B.只有③④ | C.只有③⑥ | D.只有⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
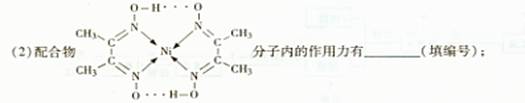
| A.氢键 | B.离子键 | C.共价键 | D.配位键 |
 等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO
等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO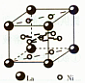
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com