
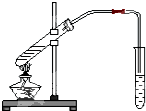
 如图为实验室制乙酸乙酯的装置.
如图为实验室制乙酸乙酯的装置.分析 (1)由于浓硫酸稀释会放热,先加入乙醇,再加入浓硫酸,最后加入乙酸,依次作答;
(2)乙酸乙酯难溶于水,密度比水小,且有果香的气味;
(3)乙酸和乙醇受热易挥发,乙酸能与碳酸钠溶液反应,乙醇易溶于水溶液.
解答 解:(1)由于浓硫酸稀释会放热,先加入乙醇,再加入浓硫酸,并不断搅拌,冷却后再加入乙酸,防止乙酸受热挥发;
故答案为:乙醇、浓硫酸、乙酸;
(2)乙酸乙酯难溶于水,密度比水小,且有果香的气味;
故答案为:小;果香;
(3)乙酸和乙醇受热易挥发,所以在加热制备乙酸乙酯时,会有乙酸和乙醇挥发出,即制得的乙酸乙酯中常含有乙醇和乙酸;乙酸能与碳酸钠溶液反应,乙醇易溶于水溶液,所以可以用饱和碳酸钠溶液洗涤后分液的方法除去;
故答案为:乙醇;乙酸;饱和碳酸钠.
点评 本题考查乙酸乙酯的制备,题目难度不大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.


科目:高中化学 来源: 题型:实验题
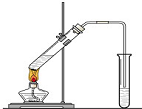 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
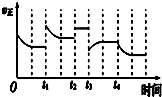 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在反应过程中,正反应速率的变化如图下列说法正确的是( )
合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,在反应过程中,正反应速率的变化如图下列说法正确的是( )| A. | t1时增大了压强 | B. | t2时充入了稀有气体 | ||
| C. | t3时升高了温度 | D. | t4时降低了温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低体系温度能加快该反应的速率 | |
| B. | 0~2S内用O2表示该反应的平均反应速率为0.15mol/(L•s) | |
| C. | 增大SO3的浓度能减慢该反应速率 | |
| D. | 反应一段时间后可生成4molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 如将一定量的SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、NH3、蔗糖分别属于强电解质、弱电解质、非电解质 | |
| B. | 石油、煤、天然气、可燃冰、植物油都属于化石燃料 | |
| C. | H2SO3(aq)+2NaOH(aq)=Na2SO3(aq)+2H2O(l)△H>-114.6 kJ/mol | |
| D. | 由石墨比金刚石稳定可推知:C(石墨)═C(金刚石)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、ClO- | |
| B. | Al3+能大量存在的溶液:Na+、NH4+、NO3-、I- | |
| C. | 与Al反应放出H2的溶液:Mg2+、Ca2+、NO3-、HCO3- | |
| D. | c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com