
有下列电解装置:①用铂电极电解AgNO3溶液 ②用锌电极电解ZnCl2溶液 ③用石墨电极电解NaOH溶液 ④用铂电极电解NaCl溶液 ⑤用铂电极电解CuSO4溶液 ⑥用铂电极电解Na2SO4溶液。当在相同的时间内通相同强度的电流时:(用序号填写)
(1)溶液中c(H+)增大的是_________________________________________;
(2)溶液中pH增大的是___________________________________________;
(3)溶液中c(H+)基本不变的是______________________________________;
(4)析出气体总体积最大的是_______________________________________;
(5)阴极析出金属质量最大的是_____________________________________。
(1)①⑤ (2)③④ (3)②⑥ (4)④ (5)①
用惰性电极电解水溶液的各种情况如下
| 类型 | 电极反应特点 | 例子 | 实际电解对象 | 电解质浓度 | 溶液pH | 电解质溶液复原 |
| 电解水型 | 阳极氢氧根放电 阴极氢离子放电 | NaOH | H2O | 增大 | 增大 | 加H2O |
| H2SO4 | H2O | 增大 | 减少 | 加H2O | ||
| Na2SO4 KNO3 | H2O | 增大 | 不变 | 加H2O | ||
| 电解质 分解型 | 电解质的离子放电 | HCl CuCl2 | HClCuCl2 | 减少减少 | 增大增大 | 加HCl 加CuCl2 |
| 放出氢气 生成碱型 | 阳极氢离子放电 | NaCl KBr | 电解质和水 | 部分离子 浓度减少 | 增大 | 加HCl 加HBr |
| 放出氧气 生成酸型 | 阳极氢氧根放电 | CuSO4 AgNO3 | 电解质和水 | 部分离子 浓度减少 | 减少 | 加CuO加Ag2O |


科目:高中化学 来源: 题型:阅读理解


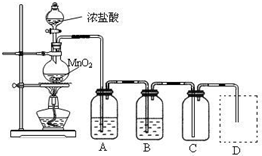
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 |
溶液为红色 溶液为红色 |
固体物质中有FeCl3 |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液紫色 不褪色 |
固体物质中不含 固体物质中不含 FeCl2 固体物质中不含 FeCl2 |
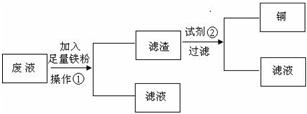
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)溶液中c(H+)增大的是_________________________________________;
(2)溶液中pH增大的是___________________________________________;
(3)溶液中c(H+)基本不变的是______________________________________;
(4)析出气体总体积最大的是_______________________________________;
(5)阴极析出金属质量最大的是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:实验题





查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com