
 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.分析 (1)K[Cr(C2O4)2(H2O)2]中配体为C2O42-、H2O,C2O42-互为等电子体的分子具有相同的原子数和价电子数;
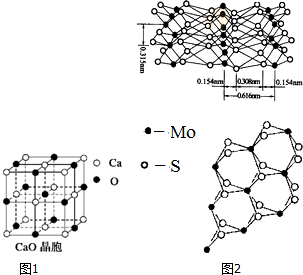
(2)由CaO晶胞结构可知,CaO晶体中每个O2-的周围有6个Ca2+,每个Ca2+的周围有6个O2-;与每一个钙离子距离最近并且距离相等的钙离子是x、y、z平面上各有4个;离子所带电荷越高、离子半径越小,晶格能越大,电量影响更大;
(3)C=O键中含有1个δ键,1个π键;Fe与CO之间形成配位键,根据生成物判断形成的化学键;
(4)①A.根据价层电子对互斥理论确定其杂化方式,含有4个共价键的原子采用sp3杂化;
B.元素的非金属性越强其电负性越大;
C.原子晶体熔点最大;
D.Mo是42号元素,其原子核外有42个电子,4d和5s电子为其价电子;
E.根据右边图判断每个Mo原子周围距离最近的S原子数目;
F.提供空轨道和提供孤电子对的原子间易形成配位键,配位键属于共价键,范德华力不属于化学键;
②MoS2结构和石墨相似,根据石墨结构分析.
解答 解:(1)K[Cr(C2O4)2(H2O)2]中配体为C2O42-、H2O,C2O42-互为等电子体的分子具有相同的原子数和价电子数,该分子为N2O4,
故答案为:C2O42-、H2O;N2O4;
(2)由CaO晶胞结构可知,CaO晶体中每个O2-的周围有6个Ca2+,每个Ca2+的周围有6个O2-,与每一个钙离子距离最近并且距离相等的钙离子是x、y、z平面上各有4个,即与每一个钙离子距离最近并且距离相等的钙离子有12个,CaO晶体中离子均为二价离子,所带电量较Na+、Cl-大,晶格能较大,
故答案为:12; CaO带的电荷数大于NaCl(1分)
(3)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应生成Fe,Fe(CO)5中Fe与CO之间形成配位键,则反应过程中,断裂的化学键只有配位键(共价键),形成金属键,
故答案为:配位键(共价键);金属键;
(4)①A.晶体硅中每个硅原子和4个硅原子能形成4个共价键,所以每个硅原子含有4个σ键且不含孤电子对,含有4个共价键的原子采用sp3杂化,故A错误;
B.元素的非金属性越强其电负性越大,S元素的非极性大于C元素,所以电负性:C<S,故B正确;
C.硅晶体属于原子晶体,C60晶体中存在分子间作用力,所以硅晶体熔点高于C60,故C错误;
D.Mo是42号元素,其原子核外有42个电子,4d和5s电子为其价电子,所以其价电子排布式为4d55s1,故D正确;
E.根据右边图知,每个Mo原子周围距离最近的S原子数目是6,故E错误;
F.提供空轨道和提供孤电子对的原子间易形成配位键,配位键属于共价键,不同元素之间易形成的配位键属于极性共价键,范德华力不属于化学键,故F错误;
故答案为:BD;
②MoS2结构和石墨相似,根据图片知,MoS2具有层状结构,Mo和S同层间以共价键结合,层与层之间通过范德华力结合,外力作用层与层易发生相对滑动,
故答案为:MoS2具有层状结构,Mo与S同层间以共价键结合,层与层之间通过范德华力结合,在外力作用下层与层间易发生相对滑动.
点评 本题考查较为综合,侧重物质结构与性质的考查,涉及知识点较多,涉及价电子对互斥理论、构造原理、电负性、配位化合物、晶体结构等,注重常考考点的考查,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
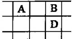 有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如图所示,下列说法正确的是( )
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如图所示,下列说法正确的是( )| A. | E元素位于周期表中的第三周期、ⅥA族 | |
| B. | B的简单阴离子比D的简单阴离子还原性强 | |
| C. | B与C形成的化合物中一定含有共价键 | |
| D. | A、B两元素形成的常见化合物的分子中均含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Ba2+、HCO3-、Cl- | |
| C. | pH=7的溶液:Fe3+、K+、SO42-、Br- | |
| D. | 0.1mol/LNaAlO2溶液:Al3+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与Cl2、盐酸均能发生反应,但生成的含铁物质组成不同 | |
| B. | 分别加热蒸干并灼烧铁、铝的氯化物溶液,最后得到的物质均为金属氧化物 | |
| C. | 等物质的量的Na、Cu、Al与足量氯气反应时,消耗的氯气一样多 | |
| D. | 常温下,铁片、铝片与浓硫酸的反应均只能停留在金属的表面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
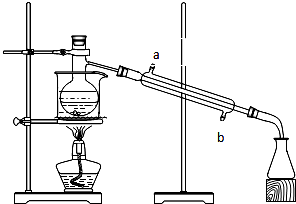 实验题:如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验
实验题:如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=y,H2O 是还原产物 | B. | n=2m,R2+ 是还原剂 | ||
| C. | m=4,O2发生氧化反应 | D. | m=2y,R2+ 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠的醇溶液,加热 | B. | 氢氧化钠的水溶液,加热 | ||
| C. | 酯、稀硫酸,加热 | D. | 银氨溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2可使石蕊试液褪色 | B. | SO2有漂白和杀菌作用 | ||
| C. | SO2溶于水后生成H2SO4 | D. | SO2是一种大气污染物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com