

分析 (1)平衡状态的判断依据是正逆反应速率相等,各组分的浓度保持不变,据此判断;
(2)依据化学平衡是哪段是列式计算平衡浓度,结合平衡常数概念计算得到平衡常数,保证A浓度不变的情况下,增大容器的体积,BC浓度减小比例相同此时浓度商和平衡常数相同,平衡不动;
(3)①该反应是一个反应前后气体体积不变的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,t8时正逆反应速率都增大且平衡不移动;
②t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动;
③t4时降压,平衡向逆反应方向移动,据此分析解答.
解答 解:(1)平衡状态的判断依据是正逆反应速率相等,各组分的浓度保持不变,
A、反应物A与B加入的反应物的物质的量之比等于其化学计量数之比,所以平衡后A与B的转化率之比等于1:1,故A错误;
B、转化率为x,则平衡后有A、B、C物质的量分别为n-nx、2n-nx、2nxmol,平衡后气体总物质的量为3n-nx,恒容容器中,气体物质的量之比等于其压强之比,故B正确;
C、恒容容器中,充入惰性气体(如Ar),平衡不移动,故C错误;
D、当2v正(A)=v逆(B)时,说明正逆反应速率相等,反应达到平衡状态,故D正确;
故选BD;
(2)在容积固定的V L密闭容器里加入n mol A、2n mol B,发生反应:A(g)+2B(g) $\frac{\underline{\;\;△\;\;}}{\;}$2C(g)△H<0,反应达平衡后测得平衡常数为K,此时A的转化率为x,
A(g)+2B(g) $\frac{\underline{\;\;△\;\;}}{\;}$2C(g)
起始量(mol) n 2n 0
变化量(mol) nx 2nx 2nx
平衡量(mol) n-nx 2n-2nx 2nx
平衡浓度为,c(A)=$\frac{n-bx}{V}$mol/L,c(B)=$\frac{2n-2nx}{V}$mol/L,c(C)=$\frac{2nx}{V}$mol/L
平衡常数K=$\frac{[C]{\;}^{2}}{[A]•[B]{\;}^{2}}$=$\frac{(\frac{2nx}{V}){\;}^{2}}{(\frac{n-nx}{V})×(\frac{2n-2nx}{V}){\;}^{2}}$=$\frac{x{\;}^{2}V}{n(1-x){\;}^{3}}$,
故答案为:$\frac{x{\;}^{2}V}{n(1-x){\;}^{3}}$;
(3)由于纵坐标只表示v逆,为了便于求解,在解题时可把v正补上,t2时平衡逆向移动,采用的条件可以是升温或增大C的浓度;t8时平衡不移动,采用的条件是使用了催化剂.
①该反应是一个反应前后气体体积减小的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,改变的条件为增大生成物C浓度或升高温度,t8时平衡不移动,采用的条件是使用了催化剂.
故答案为:增大生成物C浓度或升高温度;使用催化剂;
②t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,故答案为:逆反应;
③t4时降压,平衡向逆反应方向移动,所以逆反应速率瞬间减小,并且逐渐减小到达新的平衡,故图象为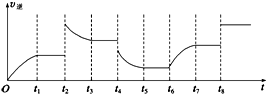 ,故答案为:
,故答案为: .
.
点评 本题考查了化学平衡常数的确定、外界条件对反应速率的影响等知识点,注意反应前后气体体积不变的可逆反应中,压强对能改变反应速率但不影响平衡的移动,图象绘制平衡影响因素的变化,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气能使湿润的蓝色石蕊试纸变为红色 | |
| B. | N2中有少量的杂质CO,可将混合气体通过灼热的氧化铜除去CO | |
| C. | 200mL3mol.L-1BaCl2溶液跟100mL3mol.L-1KCl溶液混合后,溶液中c(Cl-)仍然是3 mol/L | |
| D. | 溶液、浊液、胶体的本质区别是粒子直径的大小不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Cl-、NH4+、AlO2-、SO42- | |
| B. | 常温下,pH=14的溶液中:CO32-、Na+、S2-、AlO2- | |
| C. | 室温下,水电离出的c(OH-)=10-13mol•L-1的溶液中:K+、HCO3-、Br-、Ba2+ | |
| D. | 使甲基橙变红的溶液中:Fe2+、Al3+、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 试样中一定不含Al3+ | |
| C. | 试样与Na2CO3溶液一定不能大量共存 | |
| D. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnCl2[ZnSO4] | B. | NaOH[H2O] | C. | CuCl2[HCl] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
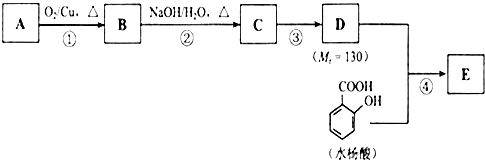
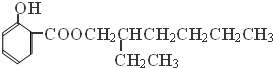 .
.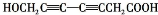 、
、 、
、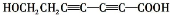 、
、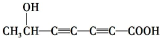 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com