
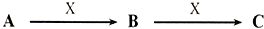
分析 (1)若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”,B为SO2、A为S,X为O2,C为SO3;
(2)若A一种黄绿色气体,则A为Cl2,X是生活中使用最广泛的一中金属,则X为Fe,B为FeCl3,氯化铁和Fe反应生成FeCl2,则C为FeCl2;
(3)若A、B、C的焰色反应均为黄色,说明都含有Na元素,A是一种工业原料,B俗称小苏打,则B为NaHCO3,电解C的水溶液可以得到两种气态产物,则C为NaCl,这两种气态产物在工业上可以合成X,则X为HCl,A为Na2CO3;
(4)若A、C为无色溶液,B为白色胶状沉淀,是治疗胃酸过多的一种药物的主要成分,B为Al(OH)3,X的焰色反应为黄色,含有Na元素,能和A反应生成氢氧化铝,则X为NaOH,氢氧化铝溶于氢氧化钠生成偏铝酸钠,则C为NaAlO2,A为AlCl3;
(5)若A、B、C均为氧化物,X是一种黑色固态非金属单质,为C,A和C反应生成B,B为CO2,CO2和C反应生成C为CO;
(6)若A是无色有刺激性气味的气体,B在空气中会立即转变为红棕色,则B为NO,B能与X反应生成C,A为NH3、C为NO2,X为O2,据此分析解答.
解答 解:(1)若A是一种淡黄色固体,B是造成酸雨的“罪魁祸首”,B为SO2、A为S,X为O2,C为SO3,通过以上分析知,X为O2,故答案为:O2;
(2)若A一种黄绿色气体,则A为Cl2,X是生活中使用最广泛的一中金属,则X为Fe,B为FeCl3,氯化铁和Fe反应生成FeCl2,则C为FeCl2,氯化铁和Cu发生氧化还原反应生成氯化亚铁和氯化铜,离子方程式为2Fe3++Cu═2Fe2++Cu2+,
故答案为:2Fe3++Cu═2Fe2++Cu2+;
(3)若A、B、C的焰色反应均为黄色,说明都含有Na元素,A是一种工业原料,B俗称小苏打,则B为NaHCO3,电解C的水溶液可以得到两种气态产物,则C为NaCl,这两种气态产物在工业上可以合成X,则X为HCl,A为Na2CO3,电解饱和氯化钠溶液生成NaOH、氢气和氯气,电解反应方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ H2↑+Cl2↑+2OH-;
(4)若A、C为无色溶液,B为白色胶状沉淀,是治疗胃酸过多的一种药物的主要成分,B为Al(OH)3,X的焰色反应为黄色,含有Na元素,能和A反应生成氢氧化铝,则X为NaOH,氢氧化铝溶于氢氧化钠生成偏铝酸钠,则C为NaAlO2,A为AlCl3,B和X生成C的反应方程式为Al(OH)3+NaOH═NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH═NaAlO2+2H2O;
(5)若A、B、C均为氧化物,X是一种黑色固态非金属单质,为C,A和C反应生成B,B为CO2,CO2和C反应生成C为CO,二氧化碳分子中C原子和每个O原子形成两个共价键,其结构式为O=C=O,1gX固体与B充分反应需要吸收14.375KJ的能量,1gC的物质的量是$\frac{1}{12}$mol,则1molC和足量二氧化碳反应吸收172.5kJ热量,其热化学方程式为C(s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol,
故答案为:O=C=O;C(s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol;
(6)若A是无色有刺激性气味的气体,B在空气中会立即转变为红棕色,则B为NO,B能与X反应生成C,A为NH3、C为NO2,X为O2,4.48LA的物质的量是0.2mol,转移电子数=0.2mol×[2-(-3)]×NA/mol=NA,故答案为:NA.
点评 本题考查无机物推断,为高频考点,侧重考查学生分析推断及知识综合应用能力,正确判断物质是解本题关键,根据物质特殊性质及物质之间的转化进行推断,注意基础知识的总结归纳,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | 在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热 | |
| C. | 未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境 | |
| D. | 加入催化剂,可以改变化学反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S?2H++S2- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaCl═Na++Cl- | D. | CH3COOH═CH3COO-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放出的能量 | |
| B. | X和Y的总能量一定高于M和N的总能量 | |
| C. | Y的能量一定高于N | |
| D. | 因为该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com