
【题目】下列事实,不能用勒夏特列原理解释的是( )
A. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
CO2(g)+NO(g) ΔH<0,升高温度可使平衡向逆反应方向移动
B. 合成NH3的反应,为提高NH3的产率,理论上应采取相对较低的温度
C. 溴水中存在平衡:Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
D. 对2HI(g)![]() H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
H2(g)+I2(g),增大平衡体系的压强(压缩体积)可使体系颜色变深
【答案】D
【解析】
使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用。勒夏特列原理的内容为如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动。
A项、该正反应为放热反应,升高温度,平衡向吸热的逆反应方向移动,可以用勒夏特列原理解释;
B项、合成氨的反应是放热反应,降低温度,平衡向正反应方向移动,NH3的产率增大,可以用勒夏特列原理解释;
C项、加入AgNO3后,Ag+与Br-反应生成AgBr沉淀,降低了Br-的浓度,平衡向正反应方向移动,溶液颜色变浅,能用勒夏特列原理解释;
D项、该反应是一个气体体积不变的可逆反应,压缩体积使压强增大,平衡不发生移动,但由于体积减小,各组分的浓度增大,故颜色变深,不能用勒夏特列原理解释;
故选D。


科目:高中化学 来源: 题型:
【题目】Ⅰ(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
(2)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______mol·L1,0.1 mol·L1的(NH4)2SO3溶液显______(填“酸性”、“碱性”或“中性”)。
Ⅱ. 某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是______ (填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______ 中(从图中选填“甲”或“乙”)。

(3)下列操作会引起实验结果偏大的是:______![]() 填编号
填编号![]() 。
。
A. 在锥形瓶装液前,留有少量蒸馏水
B. 滴定前,滴定管尖嘴有气泡,滴定后无气泡
C. 滴定终点俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是

A. a、b、c三个状态只有b是平衡状态
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2<T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比接近1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工作时,下列说法正确的是( )
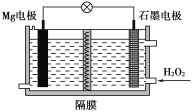
A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的碱性增强D.溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向1L恒容密闭容器中通入2mol CO2和8mol H2发生反应:CO2(g) +4H2(g)![]() CH4(g) +2H2O(g) ,5min后,测得CO2的物质的量为1.2mol ,则0~5min内用H2表示的化学反应速率是
CH4(g) +2H2O(g) ,5min后,测得CO2的物质的量为1.2mol ,则0~5min内用H2表示的化学反应速率是
A.0.16mol·L-1·min -1B.0.24mol·L-1·min -1C.0.64mol·L-1·min -1D.0.96mol·L-1·min -1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是打开物质世界奧秘之门的一把金钥匙 ,1869年,门捷列夫发现了元素周期律并发表了元素周期表。下图为元素周期表的一部分,回答下列问题。

(1).上述元素中化学性质最稳定的是________(填元素符号,下同) ,非金属性最强的是_____。
(2)c的最高价氧化物对应水化物的化学式为__________。
(3)h元素的原子结构示意图为__________,写出h单质的一种用途:__________。
(4)b、d、f三种元素原子半径由大到小的顺序是__________(用元素符号表示)。
(5)a、g、j的氢氧化物中碱性最强的是__________(填化学式),写出其溶液与g的氧化物反应的离子方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国科学家研发了一种可充电镁一溴电池,其工作原理如图所示,电池的中间是只允许镁离子通过的离子选择性膜。电池的总反应为Mg+NaBr3===NaBr+MgBr2。下列说法错误的是( )

A. 放电过程中Mg2+通过离子选择性膜从负极区移向正极区
B. 放电时,正极反应式为Br3-+2e-=3Br-
C. 负极区电解液若改为镁盐的水溶液,则会发生副反应:Mg+2H2O===Mg(OH)2+H2↑
D. 充电过程中当0.1molMg2+通过离子选择性膜时,外电路导线中通过0.1mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种微生物燃枓电池如图所示,下列关于该电池说法正确的是:

A. a电极为正极
B. H+由右室通过质子交换膜进入左室
C. a电极反应式为:C6H5OH-28e-+11H2O=6CO2↑+28H+
D. 当b电极上产生lmolN2时,溶液中将有l0mole-通过
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com