C
分析:A、从电解过程发生的氧化还原反应分析计算;
B、依据气体摩尔体积的条件应用判断;
C、从浓度换算溶质物质的量计算对应离子数分析计算;
D、从计算物质的量来计算分子中的电子数计算.
解答:A、惰性电极电解500mL饱和食盐水后,若溶液的pH值变为14,溶液中生成氢氧根离子浓度为1mol/L,物质的量为0.5L×1mol/L=0.5mol,根据电解原理可知消耗氢离子为0.5mol,依据电极反应2H
++2e
-=H
2↑,则电极上转移的电子数目为0.5N
A,故A错误;
B、在标准状况下三氧化硫为固体,不能用标准状况下的气体摩尔体积计算,故B错误;
C、1L 1mol?L
-1的FeCl
3溶液中含FeCl
3为1mol,完全电离生成氯离子为3mol,即3N
A,故C正确;
D、9g重水(D
2O)物质的量=
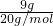
=
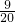
mol,含有的电子物质的量为
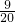
×10=4.5mol,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,电解原理的应用和计算,气体摩尔体积的应用条件,注意重水的摩尔质量是20g/mol.

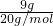 =
=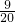 mol,含有的电子物质的量为
mol,含有的电子物质的量为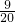 ×10=4.5mol,故D错误;
×10=4.5mol,故D错误;

 同步练习强化拓展系列答案
同步练习强化拓展系列答案