
【题目】硫酸镁还原热解制备高纯氧化镁是一种新的探索,以解决氧化镁在医药、建筑等行业的应用广泛。现以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
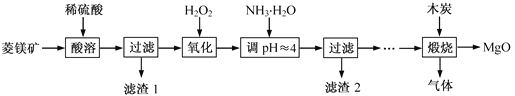
(1)酸溶所涉及反应的离子方程式为_________________________________________、_________________________________________________________。
(2)加入H2O2氧化的作用是_________________,滤渣2的成分是___________(填化学式)。
(3)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
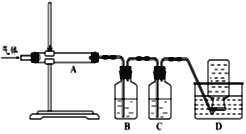
①B中盛放的溶液可以是______(填字母)。
a.NaOH 溶液 b.Na2CO3溶液 c. KMnO4溶液 d. 稀硝酸
②C装置的作用是______________________,D中收集的气体可以是 _______(填化学式)。
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:________________________________________________ 。
【答案】 MgCO3+2H+=Mg2++CO2↑+H2O FeCO3+2H+=Fe2++CO2↑+H2O 将Fe2+氧化转化为Fe3+ Fe(OH)3 c 吸收CO2气体 CO 3S+6OH-![]() 2S2-+SO32-+3H2O
2S2-+SO32-+3H2O
【解析】试题分析:由流程可知,菱镁矿经酸溶后过滤,滤液中Fe2+经双氧水氧化后,再加氨水把Fe3+沉淀为Fe(OH)3,过滤,滤液硫酸镁经处理后煅烧得到氧化镁。
(1)酸溶所涉及反应的离子方程式为MgCO3+2H+=Mg2++CO2↑+H2O、FeCO3+2H+=Fe2++CO2↑+H2O。
(2)加入H2O2氧化的作用是将Fe2+氧化转化为Fe3+,滤渣2的成分是Fe(OH)3。
(3)由题中信息及装置可知,经综合分析,气体经A装置后,S蒸气冷凝为固态,再经B吸收SO2,再经C吸收CO2,最后用排水集气法收集CO。
①B中盛放的溶液可以是KMnO4溶液,选c。.NaOH 溶液和Na2CO3溶液也能吸收CO2, 稀硝酸不能吸收除其中任何气体。
②C装置的作用是吸收CO2气体,D中收集的气体可以是CO。
③A中得到的淡黄色固体S与热的NaOH溶液反应,产物中元素最高价态为+4,根据化合价的变化规律可知,产物为亚硫酸钠和硫化钠,该反应的离子方程式为3S+6OH-![]() 2S2-+SO32-+3H2O。
2S2-+SO32-+3H2O。


科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面,锂混杂于其中.从该废料中回收(CoO) 的工艺流程如图: 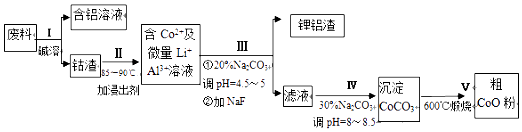
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根) . 在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 .
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3 , 碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式 .
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是 .
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是(填序号).
A.c(Na+)=2c(CO32﹣)
B.c(Na+)>c(CO32﹣)>c(HCO3﹣)
C.c(OH﹣)>c(HCO3﹣)>c(H+)
D.c(OH﹣)﹣c(H+)=c(HCO3﹣)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量变化的说法正确的是
A.冰融化成水放出热量
B.化学键断裂过程一定放出能量
C.生成物的总能量一定低于反应物的总能量
D.化学键的断裂和形成是化学反应中能量变化的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+ ![]() O2(g)=
O2(g)= ![]() N2(g)+H2O(l)△H=+267kJmol﹣1
N2(g)+H2O(l)△H=+267kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某可逆反应aA(s)+bB(g)cC(g)在一密闭的容器中达到平衡,如果t0时,改变某一外界条件,化学反应速率(v)﹣时间(t)图象如图所示.下列说法正确的是( )
A.若a+b=c,则t0时可能是增大反应体系的压强
B.若a+b=c,则t0时不可能是加入催化剂
C.若a+b≠c,则t0时只可能是加入催化剂
D.若a+b≠c,则t0时有可能是增大反应体系的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,如图烧杯中各盛有50mL的溶液. 
(1)甲溶液PH=;
(2)若将甲溶液全部倒入乙中,所得的混合溶液的PH丙溶液的PH(填“>”、“<”或“=”).
(3)若将乙溶液全部倒入丙中,所得的混合溶液PH>7,所得溶液中离子浓度大小顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。
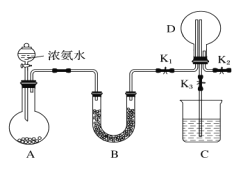
(1)装置A中烧瓶内试剂可选用___________(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的______(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_________试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放______溶液(填化学式),反应的离子方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com