
【题目】I.布朗斯特(Brnsted)和劳莱(Lowry)的质子理论认为,凡是给出质子(H+)的任何物质(分子或离子)都是酸;凡是接受质子(H+)的任何物质都是碱。简单地说,酸是质子的给予体,而碱是质子的接受体。酸和碱之间的关系表示如:酸![]() 质子(H+)+ 碱
质子(H+)+ 碱
(1)根据酸碱质子理论,既能看成酸又能看成碱的是_____________。(均填序号)
①![]() ②HS- ③
②HS- ③![]() ④H2O ⑤H3O+ ⑥Na+
④H2O ⑤H3O+ ⑥Na+
(2)已知反应C6H5OH + ![]() =C6H5O - +
=C6H5O - +![]() ,则C6H5O – 和
,则C6H5O – 和![]() -碱性较强的是__________。
-碱性较强的是__________。
Ⅱ.(3)水的离子积常数为Kw ,弱酸HA的电离平衡常数为Ka,NaA的溶液中A-的水解平衡常数为Kh ,根据它们的平衡常数表达式判断,Ka与Kh的关系为__________________。
(4)已知常温下弱酸HA的电离平衡常数为K=1.75× 10-5,常温下向0.2mol/L的HA的溶液中加入等体积0.1mol/L的NaOH溶液,该溶液pH值___7(填“>”或 “=”或 “<”),该溶液粒子浓度关系正确的是____。
A.2c(Na+)> c(HA)+c(A-)
B.c(A-)—c(HA)=2[c(H+)—c(OH-)]
C.c(A-)> c(Na+)> c(HA)> c(H+)>c(OH-)
D.c(Na+)>c(A-)> c(HA)>c(H+)> c(OH-)
【答案】②④ ![]() Ka ˙Kh = Kw < BC
Ka ˙Kh = Kw < BC
【解析】
(1)根据酸碱质子理论进行分析;
(2)根据离子结合氢离子的能力强弱判断碱性的强弱;
(3)弱酸HA的电离及A-水解的电离平衡常数判断;
(3)利用水解平衡常数Kh=![]() 计算及判断。
计算及判断。
(1)①CO32-只能结合氢离子,生成CO2,不能给出氢离子,故①错误;
②HS-能接受氢离子变成H2S,能给出氢离子变成S2-,所以既是酸又是碱,故②正确;
③NH4+能给出氢离子变成氨气,不能接受氢离子,属于酸,故③错误;
④H2O能接受氢离子变成H3O+,能给出氢离子变成OH-,所以既是酸又是碱,故④正确;
⑤H3O+能给出氢离子变成氨气,不能接受氢离子,属于酸,故⑤错误;
⑥Na+既不能接受氢离子,也不能给出氢离子,所以既不是酸又不是碱,故⑥错误;
答案选②④;
(2)已知反应C6H5OH + ![]() =C6H5O - +
=C6H5O - +![]() ,则
,则![]() 结合H+的能力强于C6H5O – ,故碱性较强的是
结合H+的能力强于C6H5O – ,故碱性较强的是![]() ;
;
(3)弱酸HA的电离方程式为:HA![]() H++A-,根据电离方程式可知,Ka=
H++A-,根据电离方程式可知,Ka= ,A-水解的反应方程式为:A-+H2O
,A-水解的反应方程式为:A-+H2O![]() HA+OH-,根据水解方程式可知,Kh=
HA+OH-,根据水解方程式可知,Kh= ,则Ka×Kh=c(H+)×c(OH-)=Kw,故答案为:Ka·Kh = Kw;
,则Ka×Kh=c(H+)×c(OH-)=Kw,故答案为:Ka·Kh = Kw;
(4)常温下向0.2mol/L的HA的溶液中加入等体积0.1mol/L的NaOH溶液,二者反应后得到等物质的量浓度的HA和NaA的混合溶液,根据物料守恒得c(HA)+c(A-)=![]() =0.1mol/L;根据上述分析可知,A-的水解平衡常数Kh=
=0.1mol/L;根据上述分析可知,A-的水解平衡常数Kh=![]() =
=![]() =5.7×10-10 < Ka,说明HA的电离程度大于A-的水解程度,溶液呈酸性,则pH<7;
=5.7×10-10 < Ka,说明HA的电离程度大于A-的水解程度,溶液呈酸性,则pH<7;
A.因两溶液混合后得到的是等物质的量浓度的HA和NaA的混合溶液,根据物料守恒得2c(Na+)= c(HA)+ c(A-),选项A错误;
B. 根据物料守恒得2c(Na+)= c(HA)+ c(A-),根据电荷守恒得c(Na+)+ c(H+)= c(OH-)+ c(A-),将两式合并得:c(A-)-c(HA)=2[c(H+)-c(OH-)],选项B正确;
C. 根据上述分析可知,HA的电离程度大于A-的水解程度,溶液呈酸性,根据电荷守恒可知c(A-)>c(Na+),c(A-)> c(Na+)> c(HA)> c(H+)> c(OH-),选项C正确;
D. 因HA的电离程度大于A-的水解程度,溶液呈酸性,则c(A-)> c(Na+)> c(HA)> c(H+)> c(OH-),选项D错误;
答案选BC。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应Ⅰ的化学方程式是______________________________________
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为____________________。
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。

①X代表的物理量是__________。
②判断L1、L2的大小关系:L1_______L2,并简述理由:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)常温下,回答下列问题:(提示:lg2 = 0.3)
(1)pH=4的硫酸溶液中,由水电离出的氢离子浓度为____________________________;
(2)将pH=11的氢氧化钡稀释105倍后pH为____________________________________;
(3)将pH=11的氨水稀释100倍后pH范围为___________________________________;
(4)将pH=2的盐酸与pH=5的硫酸等体积混合后pH为__________________________;
(5)pH=a的盐酸与pH=b的氢氧化钠混合后pH=7,且a+b=13,则V酸:V碱=________。
(II)反应A(s)+2B(g)2C(g)在密闭容器中达到平衡。
(1)若升高温度能使C的物质的量减小,则正反应是___(填“吸热”或“放热”)反应。
(2)若增加A的物质的量,平衡________(填“正向”或“逆向”或“不”)移动。
(3)若增大压强,平衡________(填“正向”或“逆向”或“不”)移动。
(4)若增加C的浓度,B(g)的转化率________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是( )
A.多电子原子轨道能量高低:4s>3p>3s>2px=2py
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:NaCl>SiO2>Hg>P4
D.晶格能由大到小:KF>KCl>KB>KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
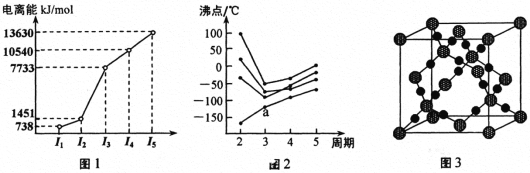
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
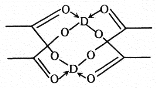
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。
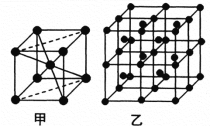
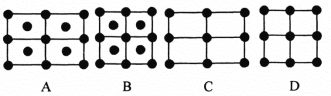
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.0.1 mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=11
C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应NH3(g)+HCl(g)![]() NH4Cl(s)能自发进行,则该反应△H>0
NH4Cl(s)能自发进行,则该反应△H>0
B. 氨水溶液加水稀释后,溶液中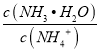 的值减小
的值减小
C. 1L1 molL-1的NaClO溶液中含有ClO-的数目为6.02×1023
D. 一定条件下,反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)>v逆(SO3)
2SO3(g)△H<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)>v逆(SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种,在一定条件下可与H2发生加成反应。下列关于该化合物的说法不正确的是( )
)是最简单的一种,在一定条件下可与H2发生加成反应。下列关于该化合物的说法不正确的是( )
A.与环戊烯互为同分异构体B.所有碳原子不可能处于同一平面
C.二氯代物有3种D.生成1 molC5H12至少需要2 molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com