
I.工业上可用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)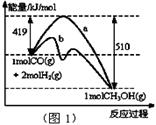
(1)“图1”表示反应中能量的变化,曲线 (填“a或b”)表示使用了催化剂;该反应的热化学方程式为 。
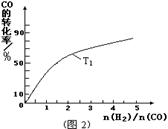
(2)若容器容积不变,下列措施可增大CO平衡转化率的是_____。
| A.升高温度 |
| B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 |
| D.再充入1 mol CO和2 mol H2 |
 BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。(16分)
(1)b(1分)
CO(g)+2H2(g) CH3OH(g) △H=-91kJ/mol (3分,方程式含状态符号正确给1分;反应热2分,其中单位写错扣1分,但结果或符号写错不给分,可逆符号也可以写成等号)
CH3OH(g) △H=-91kJ/mol (3分,方程式含状态符号正确给1分;反应热2分,其中单位写错扣1分,但结果或符号写错不给分,可逆符号也可以写成等号)
(2)BD(4分,答对1个给2分,但错选不给分)
(3)如图(2分,作图1分,标注1分)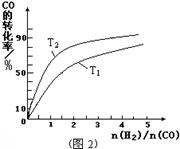
(4)解:设发生转化的BaSO4的物质的量为x mol ,则平衡时c(SO42-)为x mol/L
BaSO4 + CO32-  BaCO3 + SO42-
BaCO3 + SO42-
起始浓度/mol?L-1 2.0 0
变化浓度/mol?L-1 x x
平衡浓度/mol?L-1 2.0-x x
K= =
= 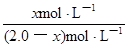 = 4.0×10-2(2分,单位无写不扣分)
= 4.0×10-2(2分,单位无写不扣分)
解得:x = 7.7×10-2 (或0.077) 即发生转化的BaSO4的物质的量为7.7×10-2 mol。(2分,单位及有效数字错误各扣1分)
解析试题分析:(1)读图,反应物能量高于生成物能量,该反应的焓变为-91kJ/mol,曲线b有2个峰,a只有1个峰,且前者的2个峰均低于后者的1个峰,说明b使用了催化剂,将1个化学反应变为2个先后或连续发生的化学反应,且降低了反应的活化能,但是对总反应的焓变无影响,所以该反应的热化学方程式为CO(g)+2H2(g) CH3OH(g) △H=-91kJ/mol;(2)由于正反应是放热反应,其它条件相同时,升高温度平衡向逆反应方向移动,则CO平衡转化率减小,故A错误;甲醇是生成物,从平衡体系移走生成物,减小生成物浓度,平衡向正反应方向移动,反应物平衡转化率增大,故B正确;由于容器容积不变,虽然充入氦气增大压强,但是平衡体系各组分的物质的量、物质的量浓度均不变,所以平衡不能移动,反应物平衡转化率保持不变,故C错误;再充入1molCO和2molH2,就是增大压强,由于正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,反应物的平衡转化率增大,故D正确;(3)读图,横坐标表示氢气和一氧化碳的起始组成比,纵坐标表示CO的平衡转化率;当氢气和一氧化碳的起始组成比为0时,CO的平衡转化率为0;当氢气和一氧化碳的起始组成比相同且不为零时,由于正反应是放热反应,降低温度平衡向正反应方向移动,CO的平衡转化率增大;当氢气和一氧化碳的起始组成比增大时,增大氢气的浓度,平衡向正反应方向移动,CO的平衡转化率增大;根据上述要点作图,可以画出温度为T2时,CO的平衡转化率随氢气和一氧化碳的起始组成比变化的示意图;(4)设硫酸钡溶解的物质的量为xmol,由于BaSO4 + CO32-
CH3OH(g) △H=-91kJ/mol;(2)由于正反应是放热反应,其它条件相同时,升高温度平衡向逆反应方向移动,则CO平衡转化率减小,故A错误;甲醇是生成物,从平衡体系移走生成物,减小生成物浓度,平衡向正反应方向移动,反应物平衡转化率增大,故B正确;由于容器容积不变,虽然充入氦气增大压强,但是平衡体系各组分的物质的量、物质的量浓度均不变,所以平衡不能移动,反应物平衡转化率保持不变,故C错误;再充入1molCO和2molH2,就是增大压强,由于正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,反应物的平衡转化率增大,故D正确;(3)读图,横坐标表示氢气和一氧化碳的起始组成比,纵坐标表示CO的平衡转化率;当氢气和一氧化碳的起始组成比为0时,CO的平衡转化率为0;当氢气和一氧化碳的起始组成比相同且不为零时,由于正反应是放热反应,降低温度平衡向正反应方向移动,CO的平衡转化率增大;当氢气和一氧化碳的起始组成比增大时,增大氢气的浓度,平衡向正反应方向移动,CO的平衡转化率增大;根据上述要点作图,可以画出温度为T2时,CO的平衡转化率随氢气和一氧化碳的起始组成比变化的示意图;(4)设硫酸钡溶解的物质的量为xmol,由于BaSO4 + CO32-  BaCO3 + SO42-中各物质的系数之比等于物质的量之比,则碳酸根离子、硫酸根离子的变化物质的量均为xmol,由于饱和碳酸钠溶液的体积为1L,由于c=n/V,则碳酸根离子、硫酸根离子的变化物质的量浓度均为xmol/L,由此推断该可逆反应中有关组分的(起始、变化、平衡)浓度,则:
BaCO3 + SO42-中各物质的系数之比等于物质的量之比,则碳酸根离子、硫酸根离子的变化物质的量均为xmol,由于饱和碳酸钠溶液的体积为1L,由于c=n/V,则碳酸根离子、硫酸根离子的变化物质的量浓度均为xmol/L,由此推断该可逆反应中有关组分的(起始、变化、平衡)浓度,则:
BaSO4 + CO32-  BaCO3 + SO42-
BaCO3 + SO42-
起始浓度/mol?L-1 2.0 0
变化浓度/mol?L-1 x x
平衡浓度/mol?L-1 2.0-x x
K= =
= 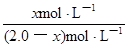 = 4.0×10-2
= 4.0×10-2
解得:x = 7.7×10-2 (或0.077)
即发生转化的BaSO4的物质的量为7.7×10-2 mol。
考点:考查化学反应原理,涉及催化剂对反应体系能量的影响、根据图像书写热化学方程式、外界条件对平衡移动的影响、画出CO平衡转化率随温度、反应物起始配比变化的示意图、沉淀转化中的有关平衡常数和沉淀转化量的计算等。


科目:高中化学 来源: 题型:填空题
氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol-1
则a为 。
(2)反应2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。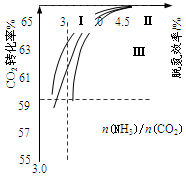
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值分别为:
A. 0.6~0.7 B. 1~1.1 C. 1.5~1.61
生产中应选用水碳比的数值为 (选填序号)。
②生产中氨碳比宜控制在4.0左右,而不是4.5的原因可能是 。
(3)尿素可用于湿法烟气脱氮工艺,其反应原理为:
NO+NO2+H2O=2HNO2 2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
①当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)= (空气中氧气的体积含量大约为20%)。
②下图是尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为 %。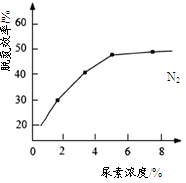
(4)下图表示使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造出既能提供能量,同时又能实现氮固定的新型燃料电池。请写出该电池的正极反应式 。生产中可分离出的物质A的化学式为 。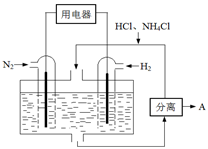
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | N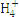 | S | N | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
 O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ①
O2(g) H2O(g) ΔH="-241.8" kJ·mol-1 ① O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ②
O2(g) CO(g) ΔH="-110.5" kJ·mol-1 ② 2NO(g) ΔH>0
2NO(g) ΔH>0查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知下列热化学方程式:
①C(s)+O2(g)=CO2(g) △H1 =-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H2 =-566.0 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) △H3 =-571.6 kJ·mol-1
通过计算(要有计算过程),写出1 mol C与液态H2O反应生成CO和H2的热化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) 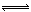 CH3OH(g)。
CH3OH(g)。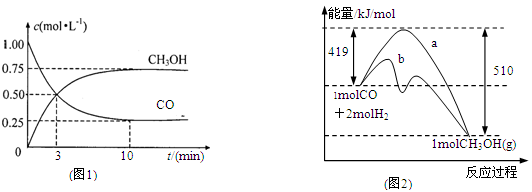
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是_________(选填“吸热”或“放热”)反应,写出反应的热化学方程式 。
(3)该反应平衡常数K为______________,温度升高,平衡常数K_________(填“增大”、“不变”或“减小”)
(4)恒容条件下,下列措施中能使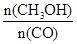 增大的有
增大的有
a.升高温度 b.充入He气
c.再充入2 molH2 d.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ?H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g) ?H = -566.0 kJ/mol
H2O(g)=H2O(1) ?H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。
(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
I.甲醇是一种优质燃料,可制作燃料电池。工业上可用下列两种反应制备甲醇:
已知:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
2H2(g)+ O2(g)=2H2O(g) ΔH3
则2CO(g)+O2(g)=2CO2(g) 的反应热ΔH=____ ___(用ΔH1、ΔH2、ΔH3表示)。
II.工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量的影响如下图: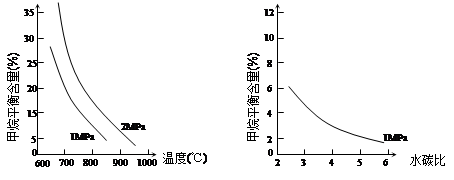
图1(水碳比为3) 图2(800℃)
(1)温度对该反应的反应速率和平衡移动的影响是 。
(2)其他条件不变,请在图2中画出压强为2 MPa时,CH4平衡含量与水碳比之间关系曲线。(只要求画出大致的变化曲线)
(3)已知:在700℃,1MPa时,1mol CH4与1mol H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少?(写出计算过程,结果保留小数点后一位数字。)
III.某实验小组设计如图a所示的电池装置,正极的电极反应式为____ ____。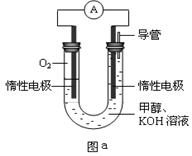
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: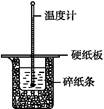
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”或“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”)。所求中和热 (填“相等”或“不相等”),简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ,用50 mL 0.50 mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会 (均填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com