
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子的轨道表达式(电子排布图)为___。
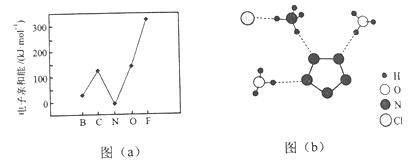
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___;氮元素的E1呈现异常的原因是___。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为___,不同之处为____。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____、____。
(4)R的晶体密度为d g·cm-3,其立方晶胞参数为anm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为____。
【答案】 同周期随着核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N的2p能级处于半充满状态,相对稳定,不易结合一个电子 ABD C (H3O+)O—H…N (NH4+)N—H…N
同周期随着核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N的2p能级处于半充满状态,相对稳定,不易结合一个电子 ABD C (H3O+)O—H…N (NH4+)N—H…N ![]()
【解析】
(1)氮原子价层电子的轨道表达式(电子排布图)为 。
。
(2)同周期元素随着核电荷数依次增大,原子半径逐渐变小,所以原子核对核外电子的吸引力逐渐增强,故结合一个电子释放出的能量依次增大,所以第二周期元素除了N元素外,其他元素的E1自左而右依次增大。由于N的2p能级处于半充满状态,相对稳定,不易结合一个电子,所以氮元素的E1反常地低。
(3)①(N5)6(H3O)3(NH4)4Cl中的两种阳离子为H3O+和NH4+,从结构角度分析,H3O+和NH4+的中心原子的价电子数都是4,都采取sp3杂化,离子内部的两种原子之间都以共价键结合,其中都有1个配位键,由于H3O+的中心原子上有一对孤电子对,所以H3O+为三角锥形,NH4+的中心原子上没有孤电子对,所以为正四面体。故相同之处选ABD,不同之处选C。
②从图中可以看出,(N5)6(H3O)3(NH4)4Cl中的氢键有NH4+中的N上连接的H和Cl-之间、H3O+中的O上连接的H和N5-中的N、NH4+中N上连接的H和N5-中的N之间,表示式为(NH4+)N-H┄Cl、(H3O+)O—H┄N、(NH4+)N—H┄N。
(4)R的立方晶胞参数为anm,所以晶胞的体积为(a×10-7)3cm3,R的晶体密度为d g·cm-3,所以晶胞的质量为(a×10-7)3d g。晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,所以有![]() ,所以y=
,所以y=![]() 。
。


科目:高中化学 来源: 题型:
【题目】向一定体积 CaCl2 和 HCl 的混合溶液中逐滴加入浓度为 1.00mol·L-1的 Na2CO3溶液,反应过程中加入的 Na2CO3 溶液的体积与产生沉淀或气体的质量关系如图所示。
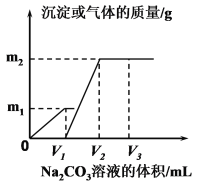
已知:图中 V1 :V2=1:2,当加入 V2mL Na2CO3溶液时,所得溶液的浓度为 1.00 mol·L-1,体积为 200mL。求:
(1)混合溶液中 CaCl2和 HCl 物质的量之比n(CaCl2)∶n(HCl)=_______(2)m2=______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒容的密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) ![]() CH3OH(l)+H2O(l)。下列选项表明反应一定达到平衡状态的是
CH3OH(l)+H2O(l)。下列选项表明反应一定达到平衡状态的是
A.CO2和H2的体积分数保持不变B.混合气体的平均式量保持不变
C.CO2和H2的转化率相等D.混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水星大气中含有一种被称为硫化羰(化学式为COS)的物质。已知硫化羰与CO2的结构相似,但能在O2中完全燃烧,下列有关硫化羰的说法正确的是( )
A. 硫化羰的电子式为![]() B. 硫化羰分子中三个原子位于一条折线上
B. 硫化羰分子中三个原子位于一条折线上
C. 硫化羰的沸点比二氧化碳的低D. 硫化羰在O2中完全燃烧后的产物是CO2和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列八种物质:①食盐晶体;②乙醇;③冰醋酸(纯醋酸晶体);④NaHSO4;⑤KNO3溶液;⑥熔融的氢氧化钠;⑦液态氯化氢;⑧Cl2。
(1)填空回答(填序号):
a、以上物质属于非电解质的是______。
b、以上物质可以导电的是________。
(2)写出④溶于水时的电离方程式________。
Ⅱ.按要求回答下列问题:
(1)等质量的CO2和CO:所含气体的分子数之比为_____;
(2)实验室里盛放氢氧化钠溶液的试剂瓶瓶塞不能用玻璃塞,用离子方程式表示其中的原因_____;
(3)我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3 +KI+H2SO4 = K2SO4+ I2+H2O。
①将上面氧化还原反应的化学方程式配平___。
②如果反应中转移0.5mol电子,则生成I2的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢大麻酚具有抗癌、抗菌等作用,其结构简式如图所示。下列说法不正确的是( )

A.每个四氢大麻酚分子中含有2个手性碳原子
B.四氢大麻酚能与FeCl3溶液发生显色反应
C.1mol四氢大麻酚最多可与1molBr2发生反应
D.1mol四氢大麻酚与NaOH溶液反应,最多消耗2 molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
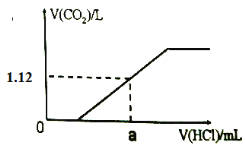
【题目】取碳酸钠和碳酸氢钠的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g。回答下列问题:
(1)若取等质量的原混合物溶于水,配成80mL溶液,则c(Na+) = ______mol·L-1;
(2)向(1)所配溶液中逐滴滴加1mol·L-1的稀盐酸至过量,生成的CO2体积(标准状况下)与加入的盐酸体积有如下图关系(不考虑CO2在水中的溶解),则a点消耗盐酸的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。

则:①写出下列物质的化学式:
丙__________,B____________,C__________, D____________。
②写出甲跟乙反应的化学方程式:__________________________。
③单质丙与溶液乙反应生成气体B的离子方程式:___________________。
(2)如图是各物质的反应关系图:已知A和E都是黄色粉末,F有刺激性气味且有漂白性。请据此回答下列问题:

写出图中编号的化学方程式:
①_______________________;
②_______________________;
③______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种半水煤气中主要含![]() 、CO、
、CO、![]() 、
、![]() 和少量
和少量![]() ,经“脱硫”、转换反应可制得合成氨原料气。
,经“脱硫”、转换反应可制得合成氨原料气。
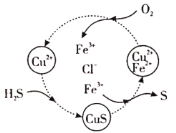
(1)这种半水煤气跟空气按一定比例混合后通入![]() 、
、![]() 的混合溶液中完成“脱硫”,其转化过程如图所示,该过程中发生多个反应,总反应为
的混合溶液中完成“脱硫”,其转化过程如图所示,该过程中发生多个反应,总反应为![]() ,该转化过程中起催化作用的离子为____,写出该过程中属于非氧化还原反应的离子方程式___。
,该转化过程中起催化作用的离子为____,写出该过程中属于非氧化还原反应的离子方程式___。
(2)脱硫后的半水煤气与水蒸气以1:15比例混合后通入转换塔中,变换反应为:![]() 。该反应用氧化铁作催化剂,其活性组分是四氧化三铁。研究发现,变换反应经下列两步完成:
。该反应用氧化铁作催化剂,其活性组分是四氧化三铁。研究发现,变换反应经下列两步完成:
第一步:![]()
![]() (慢反应)
(慢反应)
第二步:![]()
![]() (快反应)
(快反应)
①在下图中绘制变换反应(经上述催化反应过程)的“能量~反应过程”示意图___。
②由于![]() 和CO还原性较强,能够将氧化铁直接还原成铁而使催化剂失活,但实际生产中一般不会发生这种情况,请从反应速率,化学平衡角度解释可能的反应过程原因是____。
和CO还原性较强,能够将氧化铁直接还原成铁而使催化剂失活,但实际生产中一般不会发生这种情况,请从反应速率,化学平衡角度解释可能的反应过程原因是____。
(3)半水煤气处理后得到的混合气中,可通过在熔融碳酸盐中经电化学还原消除其中的二氧化碳,并得到高纯度的碳,写出生成碳的电极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com