
【题目】我国高校目前联合研究一种稀土制冷材料,其主要成分是LaCaMnO.
(1)猛原子的基态价层电子排布式为__.
(2)S与O为同主族元素,其中电负性较大的是__; H2S分子中S原子杂化轨道类型为__;试从结构角度解释H2SO4的酸性大于H2SO3的酸性:__.
(3)据报道,Ca在空气中点燃生成CaO和少量Ca2N2.
①Ca2N2和水反应生成NH2﹣NH2,NH2﹣NH2能否作配体?__(填“能”或“否”)
②CaO形成的晶体与NaCl晶体一样,为面心立方最密堆积,则一个CaO晶胞中含 有Ca2+数为__;欲比较CaO与NaCl的晶格能大小,需考虑的数据是__.
【答案】(1)3d34s2(2)O sp3硫酸分子中的非羟基氧原子数比亚硫酸多(3)①能②4钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数
【解析】
试题(1)锰是25号元素,3d和4s上的电子是其价电子,根据构造原理知其价电子排布式为:3d34s2,故答案为:3d34s2;(2)同一主族中,元素的电负性随着原子序数的增大而减小,O元素的非金属性比S强,所以O元素的电负性大于S;H2S分子中S原子含有4个价层电子对,所以其杂化轨道类型为sp3,同一元素的不同含氧酸中,非羟基氧原子数越大其酸性越强,硫酸分子中的非羟基氧原子数比亚硫酸多,所以H2SO4的酸性大于H2SO3的酸性;(3)①NH2-NH2中氮原子含有孤电子对,所以能作配体,故答案为:能;②一个CaO晶胞中含有Ca2+数=×![]() +6×
+6×![]() =4,晶格能和离子所带电荷成正比,与离子半径成反比,所以要比较钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数,故答案为:4;钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数.
=4,晶格能和离子所带电荷成正比,与离子半径成反比,所以要比较钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数,故答案为:4;钙离子、氧离子与钠离子、氯离子的离子半径与离子电荷数.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种神经保护剂的中间体,某种合成路线如下:
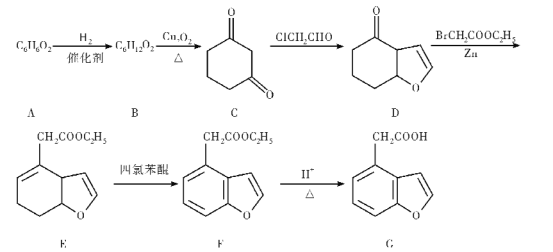
根据上述转化关系,回答下列问题:
(1)芳香族化合物A的名称是___。
(2)D中所含官能团的名称是____。
(3)B—C的反应方程式为____。
(4)F—G的反应类型___。
(5)G的同分异构体能同时满足下列条件的共有____种(不含立体异构);
①芳香族化合物②能发生银镜反应,且只有一种官能团,其中,核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:3的是__(写出一种结构简式)。
(6)参照上述合成路线,写出以![]() 和BrCH2COOC2H5为原料(无机试剂任选),制备
和BrCH2COOC2H5为原料(无机试剂任选),制备 的合成路线____________。
的合成路线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.常温常压下,22.4 L CCl4、CO2含有的分子数为1NA
B.常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应 aA(g)![]() bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
bB(g)+cC(g)达平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度变为原来的50%,则
A. 平衡向正反应方向移动 B. a>(b+c)
C. 物质B的质量分数增大 D. 以上判断都错误
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是
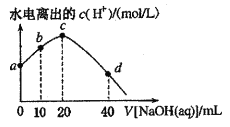
A. a点溶液中:c(H+)=6.0![]() 10-3mol
10-3mol![]() L-1
L-1
B. b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C. c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D. d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是合成药物“银屑灵”的中间体,其合成流程如下:
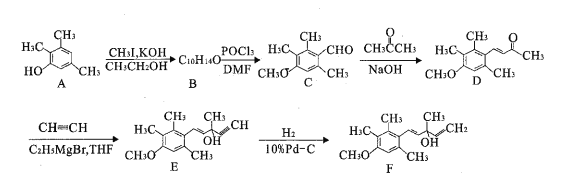
回答下列问题:
(1)化合物A的名称为________,化合物C中含氧官能团结构简式为____________。
(2)写出A→B的化学方程式:________________________________。
(3)D→E的反应类型为__________,F的分子式为______________。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:____。
①能发生银镜反应
②能发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③分子中核磁共振氢谱为四组峰
(5)设计以甲苯、乙醛为起始原料(其它试剂任选),制备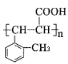 的合成路线流程图:__________
的合成路线流程图:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO![]()
![]()
![]() RCH=CHCHO
RCH=CHCHO
②![]()
③ +HCHO
+HCHO![]()
 +HCOO-
+HCOO-
回答下列问题:
(1)E中含氧官能团名称为_________非含氧官能团的电子式为_______。E的化学名称为苯丙炔酸,则B的化学名称为__________。
(2)C→D的反应类型为__________。B→C的过程中反应①的化学方程式为 ________。
(3)G的结构简式为_________。
(4)写出同时满足下列条件的F的一种同分异构体的结构简式________。
①遇FeCl3溶液显紫色;②能发生银镜反应;③分子中有五种不同化学环境的氢且个数比为1:1:2:2:4
(5)写出用甲醛和乙醇为原材料制备化合物C(CH2ONO2)4的合成路线(其他无机试剂任选,合成路线流程图示例见本题题干)。_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com