
【题目】下列说法正确的是( )
A.金属氧化物一定是碱性氧化物
B.碱性氧化物一定是金属氧化物
C.非金属氧化物一定是酸性氧化物
D.酸性氧化物一定是非金属氧化物
科目:高中化学 来源: 题型:
【题目】向KBr和KI的混合溶液中通入足量的氯气后,溶液蒸干后并将剩余物灼烧,最后残余的物质是( )
A.KCl
B.KCl和I2
C.KCl和Br2
D.KCl和KBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)乙炔是一种重要的化工原料,最新研制出的由裂解气(H2、CH4、C2H4)与煤粉在催化剂条件下制乙炔,该生产过程是目前清洁高效的煤化工过程。已知:发生的部分反应如下(在25℃、 101 kPa时),CH4、C2H4 在高温条件还会分解生成炭与氢气:
①C (s) +2H2(g)![]() CH4(g) △H1=-74.85kJmol-1
CH4(g) △H1=-74.85kJmol-1
②2CH4(g)![]() C2H4(g) +2H2(g) △H2=340.93kJmol-1
C2H4(g) +2H2(g) △H2=340.93kJmol-1
③C2H4(g)![]() C2H2(g) +H2(g) △H3=35.50kJmol-1
C2H2(g) +H2(g) △H3=35.50kJmol-1
请回答:
(1)依据上述反应, 请写出 C 与 H2化合生成 C2H2 的热化学方程式:______________。
(2)若以乙烯和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有乙烯、乙炔、氢气等。图1 为乙炔产率与进料气中 n(氢气)/n(乙烯)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________。
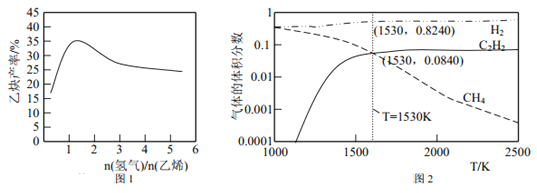
(3)图 2 为上述诸反应达到平衡时各气体体积分数和反应温度的关系曲线。
①乙炔体积分数在1530℃之前随温度升高而增大的原因可能是_______________;1530℃之后,乙炔体积分数增加不明显的主要原因可能是_______________。
②在体积为1L的密闭容器中反应,1530℃时测得气体的总物质的量为1.000 mol,则反应C2H4(g)![]() C2H2(g) +H2(g) 的平衡常数 K=_______________。
C2H2(g) +H2(g) 的平衡常数 K=_______________。
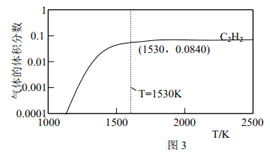
③请在图3中绘制乙烯的体积分数和反应温度的关系曲线__________。
(二)当今,人们正在研究有机锂电解质体系的锂-空气电池,它是一种环境友好的蓄电池。放电时电池的总反应为:4Li+O2===2Li2O。在充电时,阳极区发生的过程比较复杂,目前普遍认可的是按两步进行,请补充完整。电极反应式: ________________________和 Li2O2-2e-=2Li++O2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2与N2O4可相互转化:2NO2(g)![]() N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )
N2O4(g) ΔH=-24.2 kJ·mol-1,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的量浓度随时间变化的关系如下图所示。下列推理分析不合理的是( )

A. 前10 min内,用v(NO2)表示的反应速率为0.04 mol·L-1·min-1
B. 反应进行到10 min时,体系放出的热量为9.68 kJ
C. a点正反应速率小于逆反应速率
D. 25 min时,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸(HNO2)为一元弱酸,其性质与硝酸相似。已知:298K时,四种物质的电离平衡常数(K)如下表。
HNO2 | NH3·H2O | H2CO3 | H2SO3 | |
K(mol·L-1)-2 | 5.1×10-4 | 1.8×10-5 | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10﹣2 Ka2=6.3×10﹣8 |
(1)下列不能说明HNO2是弱电解质的是_____。
A.常温下0.1 mol·L-1 NaNO2溶液的pH>7
B.用一定浓度HNO2溶液做导电实验,灯泡很暗
C.等pH、等体积的盐酸和HNO2溶液分别与足量锌反应,HNO2放出的氢气较多
D.常温下,0.1mol·L-1 HNO2溶液的pH=2.3
(2)298K时,将10mL 0.1mol·L-1的亚硝酸溶液与10mL 0.1mol·L-1氨水混合,所得溶液为_____(填“酸性”、“碱性”或“中性”),原因是___________________________。
(3)若将pH=2的HNO2、HCl两溶液分别加水稀释,pH变化如右图所示,判断曲线I对应的溶液为_______(填化学式)。图中a、b、c三点对应溶液的导电能力由强到弱的顺序是
________(用a、b、c表示,下同);溶液中水的电离程度由强到弱的顺序是________。

(4)依据提供数据回答下列问题。
①求298K时,NaHSO3溶液中HSO3-水解平衡常数Kh =____;由此可判断HSO3-水解程度______电离程度(填“>”、“<”或“=”)。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
(5)298K时,向含有2mol Na2CO3的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在生活及工业中运用广泛。
(1)氮氧化物排放是形成臭氧层空洞重要成因之一,氮氧化物破坏臭氧层原理为:i. NO+O3![]() NO2+O2 K1 ii. NO2+O
NO2+O2 K1 ii. NO2+O![]() NO+O2 K2
NO+O2 K2
则反应O3+O![]() 2O2 的平衡常数K=_____(用K1、K2表示)。NO在该反应过程中的作用是_______。
2O2 的平衡常数K=_____(用K1、K2表示)。NO在该反应过程中的作用是_______。
(2)N2H4是火箭发射的助燃剂。N2H4与氨气相似,溶于水生成弱碱N2H4·H2O,写出N2H4·H2O的电离方程式___________。
(3)已知t ℃时,KW=1×10-13,则t ℃_______25℃(填“>”、“<”或“=”)。在t ℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是
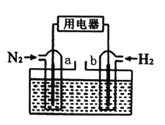
A. b电极为负极
B. 反应过程中,溶液中的Cl-向a电极移动
C. a电极的电极反应式为:N2+6e-+8H+=2NH4+
D. 电池反应为N2+3H2+2HCl=2NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )
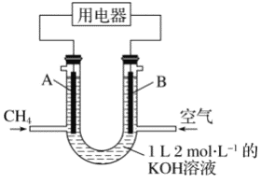
A. OH-由A端移向B端
B. V=33.6L时,溶液中的溶质为KHCO3
C. 0<V≤22.4L时,电池总反应的化学方程式为CH4+2O2+KOH===KHCO3+2H2O
D. 22.4L<V≤44.8L时,负极电极反应为CH4-8e-+9CO![]() +3H2O===10HCO
+3H2O===10HCO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com