
【题目】工业废弃铬渣对人体以及环境危害极大,铬渣含有Na2SO4及少量Cr2O72-、Fe3+;某工厂从铬渣中提取硫酸钠的工艺如图1:
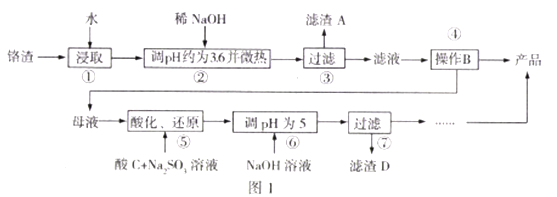
己知:I.Fe3+、Cr3+完全沉淀(c≦1.0×10-5mol/L)时pH分别为3.6和5;
Ⅱ.Cr2O72-还原产物为Cr3+。
(1)步骤2调节pH=3.6的目的为______,“微热”的作用为_______。
(2)Na2SO4和Na2Cr2O7的溶解度随温度变化曲线如图2,操作B的方法为_________.
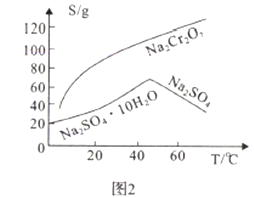
A.蒸发结晶、趁热过滤 B.蒸发浓缩,降温结晶,过滤
(3)步骤5中酸C不能选择硝酸的理由为____________,酸化、还原过程发生反应的离子方程式为_______,若将该反应设计为原电池(惰性电极),则负极的电极反应式为_______。
(4)Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=_______
(5)为了测定步骤3的滤液中Na2Cr2O7的浓度,进行步骤如下:
I.取100mL滤液;
Ⅱ.用cmol/L的标准KMnO4酸性溶液滴定bmL一定浓度的FeSO4溶液,消耗KMnO4溶液bmL;
Ⅲ.取bmL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗dmLFeSO4溶液;则步骤3的滤液中Na2Cr2O7的含量为_________mol/L。
【答案】 沉淀Fe3+ 加快反应速率、促进Fe3+水解生成Fe(OH)3而除去 A 硝酸有氧化性且会引入新的杂质 3SO32- +Cr2O72-+8H+=2Cr3++3SO42-+4H2O SO32--2e-+H2O= SO42-+2H+ 1.0×10-32 5cd/6b
【解析】(1)步骤②的目的是沉淀Fe3+,Fe3+完全沉淀时的pH=3.6,所以调节pH=3.6的目的为沉淀Fe3+;加热能加快反应速率,使Fe3+沉淀速率更快,同时因为水解反应吸热,“微热”还可以促进Fe3+水解生成Fe(OH)3而除去;(2)根据图2溶解度与温度曲线,操作B的最佳方法为先将混合溶液蒸发浓缩,趁热过滤,趁热过滤的目的是有利于硫酸钠结晶析出,可以防止Na2Cr2O7析出,故答案选A;(3)硝酸有氧化性,会氧化Na2SO3,且会引入杂质NO3-,为保证最后得到纯净的硫酸钠,酸C为硫酸,不能选用硝酸等其他酸溶液。酸化后Cr2O72-可被SO32-还原成Cr3+,SO32-变为SO42-,离子方程式为:3SO32- +Cr2O72-+8H+=2Cr3++3SO42-+4H2O;根据该反应可知,SO32-在反应中失去电子,所以负极电极反应为:SO32--2e-+H2O= SO42-+2H+;(4)恰好完全沉淀时离子浓度c=1.0×10-5mol/L, Cr3+完全沉淀时pH=5,c(OH-)=1.0×10-9mol/L,所以Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 1.0×10-5mol/L×(1.0×10-9mol/L)3=1.0×10-32;(5)根据MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,可得c(FeSO4)=5cmol/L,根据Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可得bmL滤液中含有Na2Cr2O7物质的量=![]() ×10-3mol,则c(Na2Cr2O7)=
×10-3mol,则c(Na2Cr2O7)= 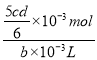 =
=![]() mol/L。
mol/L。


科目:高中化学 来源: 题型:
【题目】利用图示装置进行下列实验,能达到实验目的的是
溶液a | 固体b | 溶液c | 实验目的:验证 |
| |
A | 浓硝酸 | NaHCO3 | Na2SiO3 | 非金属性:N>C>Si | |
B | 浓盐酸 | KMnO4 | Na2S | 氧化性:KMnO4>Cl2>S | |
C | 浓盐酸 | CaCO3 | NaAlO2 | 酸性:HCl>H2CO3>Al(OH)3 | |
D | 浓氨水 | CaO | 酚酞溶液 | NH3·H2O是弱碱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融的 CaF2﹣CaO 作电解质,利用如图 所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中,正确的是( ) 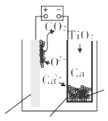
A.由 TiO2 制得 1 mol 金属 Ti,理论上外电路通过 2 mol 电子
B.阳极的电极反应式为 C+2O2﹣﹣4e﹣═CO2↑
C.在制备金属钛前后,整套装置中 CaO 的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接 Pb 电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-和泥沙,将粗盐溶于水后进行下列五步操作:①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液,正确的操作顺序是
A.①②⑤④③B.①④⑤②③
C.②⑤④①③D.⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在元素周期表中所处的位置如图所示,A、B、C三种元素原子的质子数之和为32,D元素原子的最外层电子数为其次外层电子数的2倍。则下列说法正确的是
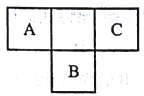
A. B的气态氢化物比C的气态氢化物稳定
B. 元素D形成的气态氢化物一定是正四面体形分子
C. A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
D. 四种元素的原子半径:B>D>A>C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com