
【题目】长期缺碘和碘摄入过量都会对健康造成危害,目前加碘食盐中碘元素绝大部分以IO3-存在,少量以I-存在。现使用Na2S2O3对某碘盐样品中碘元素的含量进行测定。
I.I-的定性检测
(1)取少量碘盐样品于试管中,加水溶解。滴加硫酸酸化,再滴加数滴5%NaNO2和淀粉的混合溶液。若溶液变________色,则存在I-,同时有无色气体产生并遇空气变红棕色。试写出该反应的离子方程式为 ___________________________________。
Ⅱ.硫代硫酸钠的制备
工业制备硫代硫酸钠的反应原理为2Na2S + Na2CO3 +4SO2 =3Na2S2O3 +CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠如下图。

先关闭K1打开K2,打开分液漏斗,缓缓滴浓硫酸,控制好反应速率。
(2)y仪器名称___________ 。此时B装置的作用是___________________________。
(3)反应开始后,C中先有淡黄色浑浊,后又变为澄清,此浑浊物为____________。(填化学式)装置D的作用是____________________________________。
(4)实验结束后,关闭K2打开K1。玻璃液封管x中所盛液体最好为________(填序号)
A.NaOH溶液 B.浓硫酸 C.饱和NaHSO3溶液
Ⅲ.碘含量的测定
巳知:①称取10.00g样品,置于250mL锥形瓶中,加水100mL溶解,加2mL磷酸,摇匀。
②滴加饱和溴水至溶液呈现浅黄色,边滴加边摇,至黄色不褪去为止(约1mL)。
③加热煮沸,除去过量的溴,再继续煮沸5min,立即冷却,加入足量15%碘化钾溶液,摇匀。
④加入少量淀粉溶液作指示剂,再用0.002mol/L的Na2S2O3标准溶液滴定至终点。
⑤重复两次,平均消耗Na2S2O3溶液9.00mL
相关反应为:I-+3Br2+3H2O = IO3-+6H++6Br-
IO3-+5I-+6H+ = 3I2+3H2O
I2+2S2O32-= 2I-+S4O62-
(5)请根据上述数据计算该碘盐含碘量为_______ mg·kg—1。
【答案】蓝 2I-+2NO2-+4H+=I2+2NO↑+2H2O 三颈烧瓶(三口烧瓶) 安全瓶(防倒吸) S 尾气处理(吸收多余的SO2气体,防止污染环境) A 38.1
【解析】
(1)淀粉遇碘单质变蓝,酸性条件下,亚硝酸根具有氧化性,可氧化碘离子成碘单质,根据氧化还原反应的规律配平该方程式;
Ⅱ.A装置制备二氧化硫,C装置中制备Na2S2O3,反应导致装置内气压减小,B为安全瓶作用,防止溶液倒吸,D装置吸收多余的二氧化硫,防止污染空气,
(2)根据实验仪器的结构特征作答;b装置为安全瓶,防止溶液倒吸;
(3)二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3;氢氧化钠溶液用于吸收装置中残留的二氧化硫,防止污染空气,据此分析作答;
(4)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收;
Ⅲ.(5)提供的方程式中可知关系式为:I-![]() IO3-
IO3-![]() 3I2
3I2![]() 6S2O32-,计算出含碘元素的物质的量,进而得出结论。
6S2O32-,计算出含碘元素的物质的量,进而得出结论。
(1)根据题设条件可知,硫酸酸化的NaNO2将碘盐中少量的I-氧化为使淀粉变蓝的I2,自身被还原为无色气体NO,其化学方程式为:2I-+2NO2-+4H+=I2+2NO↑+2H2O,
故答案为:蓝;2I-+2NO2-+4H+=I2+2NO↑+2H2O;
(2)y仪器名称为三颈烧瓶(三口烧瓶);由实验装置结构特征,可知b装置为安全瓶(防倒吸),
故答案为:三颈烧瓶(三口烧瓶);安全瓶(防倒吸);
(3)根据实验设计与目的,可知二氧化硫与硫化钠在溶液中反应得到S,硫与亚硫酸钠反应得到Na2S2O3,c中先有浑浊产生,后又变澄清,则此浑浊物为S,残余的SO2气体污染环境,装置D的作用是尾气处理(吸收多余的SO2气体,防止污染环境),
故答案为:S;尾气处理(吸收多余的SO2气体,防止污染环境);
(4)实验结束后,装置b中还有残留的二氧化硫,为防止污染空气,应用氢氧化钠溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,故A项正确,
故答案为:A;
Ⅲ.(5)从以上提供的方程式中可知关系式为:I-![]() IO3-
IO3-![]() 3I2
3I2![]() 6S2O32-,设含碘元素物质的量为x,
6S2O32-,设含碘元素物质的量为x,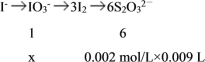
解得x = ![]() = 3.0×10-6 mol,故所含碘元素的质量为3.0×10-6 mol×127 g/mol = 3.81×10-1 mg,所以该加碘盐样品中碘元素的含量为(3.81×10-1 mg)/0.01 kg = 38.1 mg·kg—1,
= 3.0×10-6 mol,故所含碘元素的质量为3.0×10-6 mol×127 g/mol = 3.81×10-1 mg,所以该加碘盐样品中碘元素的含量为(3.81×10-1 mg)/0.01 kg = 38.1 mg·kg—1,
故答案为:38.1。


科目:高中化学 来源: 题型:
【题目】B、C、N、Si是几种常见的重要非金属元素,其形成的各种化合物在自然界中广泛存在。
(1)基态硅原子的电子排布式为________________;C、N、O元素原子的第一电离能由大到小的顺序为________________;写出一种与CO32-互为等电子体的阴离子:_________;
(2)BF3与一定量的水可形成如图所示晶体R

①晶体R中各种微粒间的作用力涉及___________(填字母代号),
a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
②晶体R中阴离子的空间构型为________________________;
(3)乙二胺(H2NCH2CH2NH2)与CuCl2溶液可形成配离子(结构如图所示),乙二胺分子中氮原子的杂化类型为________________;
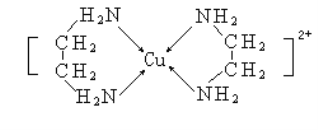
乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,其原因是__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F的路线如下:

(1)A分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为__________,写出A+B→C的化学反应方程式:____________。
(2)E是由2分子C生成的含有3个六元环的化合物,E分子中不同化学环境的氢原子有____种。
(3)D→F的反应类型是______,写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:__________________。
①属于一元羧酸类化合物②苯环上只有2个取代基且处于对位,其中一个是羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2![]() 2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
c(H2O2)/molL﹣1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
① H2O2的分解反应________氧化还原反应(填“是”或“不是”).
②该分解反应0─20min的平均反应速率v(H2O2)为________molL﹣1 min﹣1 .
③如果反应所用的H2O2溶液为100mL,则共产生O2________g.
A.0.08 B.0.16 C.1.28 D.2.4.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________,分子中σ键与π键的数目之比为___________。醋酸钠中碳原子的杂化类型___________。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________。若品体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 标准状况下,11.2LH2与11.2LD2所含的中子数均为NA
B. 1L0.1 mol/L FeCl3溶液中含Fe3+数目为0.1NA
C. 6.4gCu与3.2gO2隔绝空气加热,充分反应后,转移电子数为0.2NA
D. 0.1mol乙醇与0.1mol乙酸在浓硫酸催化并加热下,生成的乙酸乙酯为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是一种常见的化肥,某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4的工艺流程如下:

下列说法正确的是
A.通入NH3和CO2的顺序可以颠倒
B.操作1为过滤,操作2为蒸馏
C.通入的NH3和CO2均应过量,且工艺流程中CO2可循环利用
D.步骤②中反应的离子方程式为CaSO4+2NH3+CO2+H2O=CaCO3↓+2NH4++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.乙烯的产量是衡量一个国家石油化工发展水平的标志
B.含碳元素的化合物都是有机化合物
C.蛋白质水解最终生成氨基酸
D.乙烯、苯分子中的所有原子在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com