
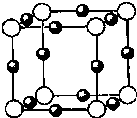
 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】| 1 |
| 4 |
| 1 |
| 8 |
| 64×3+14 |
| NA |
| ||
| (2a cm)3 |
| 103 |
| 4NA?a3 |
| 103 |
| 4NA?a3 |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A、足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O→2HCO3- |
| B、FeSO4溶液在空气中变质:4Fe2++O2+2H2O→4Fe3++4OH- |
| C、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
| D、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-→2CaCO3↓+Mg(OH)2↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A、该反应的还原剂是Cl- |
| B、消耗1mol还原剂,转移6mol电子 |
| C、氧化剂与还原剂的物质的量之比为2:3 |
| D、反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是( )
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是( )| A、Cu片上发生氧化反应 |
| B、电子由Cu片经外电路流向Zn片 |
| C、盐桥中的Cl-移向ZnSO4溶液 |
| D、一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:| 实验 编号 |
待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH通电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素A、B、C、D、F原子序数依次增大.A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,F的负一价离子与C的某种氢化物分子含有相同的电子数.
短周期元素A、B、C、D、F原子序数依次增大.A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,F的负一价离子与C的某种氢化物分子含有相同的电子数.| 容 器 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com