
| A. | 放热过程 | B. | 热力学能降低过程 | ||
| C. | 熵增过程 | D. | 自由能降低过程 |
分析 A.某些吸热反应也能自发进行;
B.某些热力学能升高的过程也能自发进行;
C.某些熵减过程也能自发进行;
D.吉布斯自由能△G=△H-T△S<0是自发过程.
解答 解:A.某些吸热反应也能自发进行,如在25℃和101kPa条件下,碳酸铵的分解,故A错误;
B.某些热力学能升高的过程也能自发进行,通常条件下,冰融化成水,故B错误;
C.某些熵减过程也能自发进行,如-10℃的液态水自动结冰,故C错误;
D.吉布斯自由能△G=△H-T△S<0是自发过程,故D正确;
故选D.
点评 本题考查了化学反应进行的方向,难度不大,焓判据和熵判据都存在一定的局限性,要综合焓判据和熵判据去判断过程的自发性.


科目:高中化学 来源: 题型:填空题
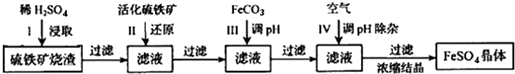
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲<乙,简单阴离子的半径:丙>丁>戊 | |
| B. | 非金属性:乙<丁 | |
| C. | 最高价氧化物对应的水化物的酸性:丙<丁 | |
| D. | 气态氢化物的稳定性:丙>丁>戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 0.1mol•L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| C. | 0.1mol•L-1的氨水中:c(H+)=c(OH-) | |
| D. | 在25℃100mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
A.K值不变,平衡可能移动 B.K值变化,平衡一定移动
C.平衡移动,K值可能不变 D.平衡移动,K值一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA水溶液中微粒浓度大小顺序:c(HA)>c(H+)>c(A-)>c(OH-) | |
| B. | NaA水溶液中:c(Na+)═c(A-)+c(HA) | |
| C. | HA与NH3作用生成的化合物是共价化合物 | |
| D. | 稀释0.1mol/LHA水溶液,其电离程度增大,pH也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
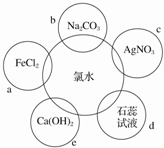
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com