
| A. | 苯酚与浓硝酸、浓硫酸反应生成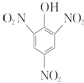 ,苯与浓硝酸、浓硫酸反应生成硝基苯 ,苯与浓硝酸、浓硫酸反应生成硝基苯 | |
| B. | 乙烯能发生加成反应,乙醇不能发生加成反应 | |
| C. | 苯酚能和氢氧化钠溶液反应,而乙醇不能和氢氧化钠溶液反应 | |
| D. | 苯酚苯环上的氢比苯分子中的氢更容易被卤素原子取代 |
分析 A.苯酚含有羟基,苯环的邻位、对位氢原子较活泼;
B.乙醇不含不饱和键,不能发生加成反应;
C.羟基连接的基团不同,导致羟基中H原子的活性不同;
D.苯酚苯环上的氢比苯分子中的氢更容易被卤原子取代,说明苯酚苯环上H原子更活泼.
解答 解:A.苯酚与浓硝酸、浓硫酸反应生成 ,苯与浓硝酸、浓硫酸反应生成硝基苯,可说明苯酚含有羟基,苯环的邻位、对位氢原子较活泼,故A不选;
,苯与浓硝酸、浓硫酸反应生成硝基苯,可说明苯酚含有羟基,苯环的邻位、对位氢原子较活泼,故A不选;
B.乙烯中含有碳碳双键性质较活泼能发生加成反应,而乙醇中不含碳碳双键,性质较稳定,乙醇不能发生加成反应,所以乙烯和乙醇性质的不同是由于含有的化学键不同而导致的,故B选;
C.苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应,说明苯环的影响使酚羟基上的氢更活泼,故C不选;
D.苯酚苯环上的氢比苯分子中的氢更容易被卤原子取代,说明苯酚苯环上H原子更活泼,说明酚-OH对苯环的影响,故D不选.
故选B.
点评 本题考查有机物的结构与性质关系,题目难度中等,关键根据原子团所处的化学环境进行比较性质差异,并熟悉官能团与物质性质的关系来解答.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{49}^{115}$In原子核外有49个电子 | |
| B. | ${\;}_{49}^{115}$In原子核内有49个中子 | |
| C. | ${\;}_{49}^{115}$In原子核内质子数和中子数之和等于其质量数,为115 | |
| D. | ${\;}_{49}^{115}$In是In元素的一种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 气体 | 除杂试剂 |
| A | CO2(HCl) | 盛饱和NaHCO3溶液的吸气瓶 |
| B | Cl2(HCl) | 盛饱和食盐水的吸气瓶 |
| C | NH3(H2O) | 盛碱石灰的球形干燥管 |
| D | SO2(HCl) | 盛饱和AgNO3溶液的吸气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4H的电子式为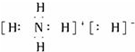 | |
| B. | NH4Cl的电子式为 | |
| C. | NH4H含有极性共价键和离子键 | |
| D. | NH4H固体投入少量热水中,有两种气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可通入过量的CO2气体来除去NaHCO3溶液中少量的Na2CO3杂质 | |
| B. | 可采用滴加少量的澄清石灰水来鉴别Na2CO3和NaHCO3两种白色固体 | |
| C. | 等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,后者放出的CO2多 | |
| D. | 通过称取ag Na2CO3和NaHCO3的混合物经充分加热冷却后恒重bg能够测出混合物中Na2CO3的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
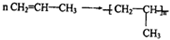 ,该反应的反应类型为加聚反应.
,该反应的反应类型为加聚反应.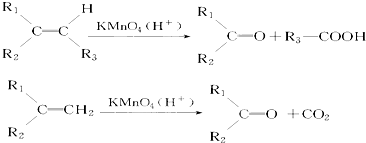
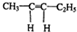 .若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(
.若该烯烃的一种同分异构体与酸性高锰酸钾溶液反应得到的产物为二氧化碳和丁酮(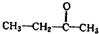 ),则此烯烃的结构简式为
),则此烯烃的结构简式为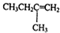 ,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.
,名称为2-甲基-1-丁烯;丁酮中官能团的名称为羰基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石膏(CaSO4•2H2O) | B. | 硫铁矿(FeS2) | ||
| C. | 纯碱(NaHCO3) | D. | 芒硝(Na2SO4•10H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
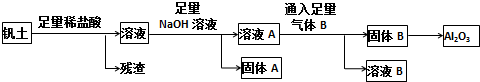
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com