
【题目】请根据所学知识回答下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______△H2(填“>”、“<”或“=”,下同)。
(2)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1_______△H2。
①P4(白磷,s)+5O2(g)=2P2O5(s) △H1
②4P(红磷,s)+5O2(g)=2P2O5(s) △H2
(3)已知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量__________57.3kJ。
(4)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、pkPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是___________________________________。
(5)氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436 kJ·mol-1、391 kJ·mol-1、946 kJ·mol-1。写出合成氨的热反应方程式:___________________________________。生成1 mol NH3需要吸收或放出________kJ。
【答案】= < > CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+2akJ/mol N2(g)+3H2(g)![]() 2NH3(g) △H=-92 kJ·mol-1 46
2NH3(g) △H=-92 kJ·mol-1 46
【解析】
(1)反应热只与反应物、生成物的始态和终态有关,而与反应条件无关,由此可确定△H1、△H2的关系。
(2)已知常温时红磷比白磷稳定,即P4(白磷,s)= 4P(红磷,s) △H<0,将①-②,即得△H=△H1-△H2<0,由此可确定△H1与△H2的大小关系。
(3)浓硫酸溶于水放热,稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,由此可得出浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量与57.3kJ的关系。
(4)书写反应的热化学方程式时,化学计量数扩大二倍,则反应热也应扩大为原来的二倍。
(5)合成氨反应为N≡N+3H-H→6N-H,△H=反应物总键能-生成物总键能,代入键能数据,即可得出反应热。
(1)反应热只与反应物、生成物的始态和终态有关,而与反应条件无关,则△H1=△H2。答案为:= ;
(2)已知常温时红磷比白磷稳定,即P4(白磷,s)= 4P(红磷,s) △H<0,将①-②,即得△H=△H1-△H2<0,所以△H1<△H2。答案为:<;
(3)浓硫酸溶于水放热,稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1,由此可得出浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量>57.3kJ。答案为:>;
(4)已知:0.5 mol CH4(g)与0.5 mol水蒸气在t℃、pkPa时,完全反应生成CO和H2的混合气体,吸收了a kJ热量,该反应的热化学方程式是CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+2akJ/mol。答案为:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+2akJ/mol;
(5)合成氨反应为N≡N+3H-H→6N-H,△H=反应物总键能-生成物总键能=946 kJ·mol-1+3×436 kJ·mol-1-6×391 kJ·mol-1=-92 kJ·mol-1。则合成氨的热反应方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=-92 kJ·mol-1;生成1 mol NH3能放出46kJ热量。答案为:N2(g)+3H2(g)
2NH3(g) △H=-92 kJ·mol-1;生成1 mol NH3能放出46kJ热量。答案为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92 kJ·mol-1;46。
2NH3(g) △H=-92 kJ·mol-1;46。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】设![]() 代表阿伏加德罗数的数值,下列说法中正确的是
代表阿伏加德罗数的数值,下列说法中正确的是![]()
![]()
A.![]() 的
的![]() 溶液中
溶液中![]() 的数目为
的数目为![]()
B.![]() 分子中碳原子之间共用电子对数为
分子中碳原子之间共用电子对数为![]()
C.电解精炼铜时,若阴极得到电子数为![]() 个,则阳极质量减少64g
个,则阳极质量减少64g
D.标准状况下,![]() 完全溶于水转移电子数为
完全溶于水转移电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向2L的密闭容器中投入一定量的X和Y,在催化剂的作用下发生反应:X(g)+Y(g) 2Z(g)。反应过程中测定的部分数据如下表:
t/min | n(X)/mol | n(Y)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
下列说法正确的是
A.反应0~2min末的平均速率υ(Z)=0.2 mol/(L·min)
B.在2min~4min间,υ(X)正<υ(Y)逆
C.生成2 mol Z的同时消耗1 mol Y能说明该反应已达化学平衡状态
D.其他条件不变,再充入1.2 mol X和0.6 mol Y,X的转化率将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是![]()
![]()
A.![]() 中所含的中子数为
中所含的中子数为![]()
B.36g葡萄糖与果糖的混合物中含有羟基的数目为![]()
C.用惰性电极电解稀硫酸的过程中,溶液的质量每减少![]() 转移电子数为
转移电子数为![]()
D.![]() 和
和![]() 之和为1mol的
之和为1mol的![]() 溶液中.含有的
溶液中.含有的![]() 数目为
数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。

(1)A装置是________(填“原电池”或“电解池”),A装置中通入SO2一极的电极反应式为________________________________________。
(2)N2O5在电解池的________(填“c极”或“d极”)区生成,其电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸在水溶液中存在下列电离平衡:CH3COOH![]() CH3COO+H+,下列说法不正确的是
CH3COO+H+,下列说法不正确的是
A.加入醋酸钠晶体后,溶液的pH增大
B.加入碳酸钠,平衡向右移动
C.加水稀释,溶液中c(H+)和c(OH-)均减少
D.升高温度,Ka(CH3COOH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积均为2L恒温密闭容器中,起始时均充入amolH2S,控制不同温度和分别在有、无Al2O3催化时进行H2S的分解实验[反应为:2H2S(g)![]() 2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
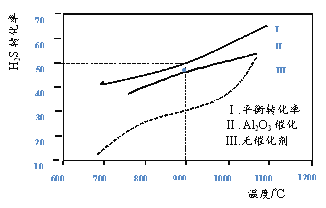
下列说法不正确的是
A. H2S分解为放热反应
B. 加入Al2O3 可提高H2S的平衡转化率
C. 900℃反应2H2S(g)![]() 2H2(g)+S2(g)的平衡常数K=0.125a
2H2(g)+S2(g)的平衡常数K=0.125a
D. 约1100℃曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.100mol· L -1AgNO3溶液滴定50.0mL0.0500mol· L -1NaCl溶液的滴定曲如右图所示[pCl=-lg(Cl-)]。下列有关描述错误的是
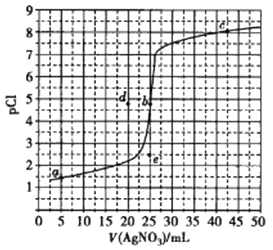
A. 室温时Ksp(AgCl)的数量级为10-10
B. 室温时,各点Ksp(AgCl)的关系:a=b=c
C. 相同实验条件下,若改用0.0400mol· L-1 NaCl溶液,反应终点b移动到d
D. 相同实验条件下,若改用0.0500ml· L-1 NaBr溶液,反应终点b向e方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu的单质和合金在生活、生产中有着广泛的应用。回答下列问题:
(1)Cu的基态原子价电子排布式为___。
(2)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是___,反应的化学方程式为___。
(3)配离子Cu(CN)32-中,中心离子的杂化类型是___,该配离子的空间构型为___;CN-中配位原子是___(填名称)。
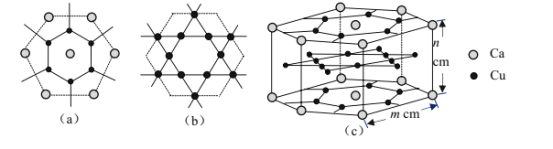
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
①该晶胞中Ca有___个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是___pm,设NA为阿伏加德罗常数的值,CaCu晶体的密度是___g/cm3(用含m、n的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com