
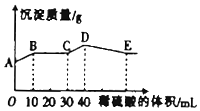
 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )| A. | AB段发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E点对应横坐标稀硫酸的体积为70mL | |
| C. | D点表示的沉淀的化学式为Al(OH)3、BaSO4 | |
| D. | E点沉淀比A点沉淀质量大2.33g |
分析 由A点可知,A点白色硫酸钡沉淀,则BaCl2过量,由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,混合液中含有氢氧根离子、偏铝酸根离子、硫酸根离子,则AB段发生生成硫酸钡沉淀和水的反应,BC段发生酸碱中和,CD段发生偏铝酸根离子与酸的反应,DE段发生氢氧化铝与酸的反应,以此来解答.
解答 解:由A点可知,A点白色硫酸钡沉淀,则BaCl2过量,由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,混合液中含有氢氧根离子、偏铝酸根离子、硫酸根离子,
A.由图象可知,AB段发生生成硫酸钡沉淀和水的反应,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A错误;
B.CD段发生偏铝酸根离子与酸的反应,DE段发生氢氧化铝与酸的反应,消耗酸的体积之比为1:3,所以DE段消耗酸的体积为30mol,所以E点对应横坐标稀硫酸的体积为70 mL,故B正确;
C、AB段发生反应生成硫酸钡沉淀和水的反应,BC段发生酸碱中和,CD段发生偏铝酸根离子与酸的反应,所以D点表示的沉淀的化学式为Al(OH)3、BaSO4,故C正确;
D、因为最后溶液为Al2(SO4)3和硫酸的混合溶液,E点沉淀比A点沉淀质量大的量就是AB段生成的硫酸钡沉淀的质量,由图可知:消耗酸的量为10ml,所以生成硫酸钡为1mol•L-1×10ml×10-3L/mL=0.01mol,所以E点沉淀比A点沉淀质量大0.01mol×233g/mol=2.33g,故D正确;
故选A.
点评 本题考查离子反应方程式的书写及图象,难度较大,明确A点的意义及混合液中的离子、离子反应的先后顺序是解答本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 着力开发风能、太阳能、地热能等清洁高效新能源,减少煤、石油等化石燃料的使用 | |
| B. | 为了减少SO2和NOx的排放,工业废气排放到大气之前必须回收处理 | |
| C. | 大力开采煤、石油和天然气,以满足经济发展和日常生活的需要 | |
| D. | 大力发展混合动力汽车、电动汽车等新能源汽车,以减少对化石能源的依赖,保护城乡环境,关爱人类生存空间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- | |
| B. | pH=1的溶液中大量存在Na+、NH4+、SiO32-、I- | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液中可能大量存在Na+、H+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
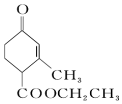 和
和  ,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;
,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;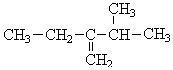 的名称为3-甲基-2-乙基-1-丁烯,
的名称为3-甲基-2-乙基-1-丁烯,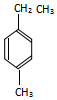 的名称为对甲基乙苯;
的名称为对甲基乙苯;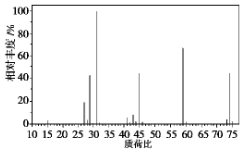
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
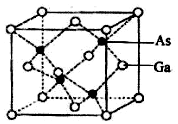 氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题:
氮、磷、砷、钛的单质及其化合物在生产生活中有重要的应用.回答下列问题: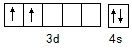 ,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.
,含Ti3+的配合物的化学式为[TiCl(H2O)5]Cl2•H2O,其配离子中含有的化学键类型为极性共价键、配位键,该配离子的配位数为6.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象或结论 |
| A | 将铁屑、溴水、苯混合加热 | 制取溴苯 |
| B | 先加入浓硫酸,再加入苯,最后滴入浓硝酸 | 制取硝基苯 |
| C | 向C6H5ONa溶液巾通入CO2气体 | 溶液出现浑浊,证明酸性:C6H5OH<H2CO3 |
| D | 乙醇和浓硫酸混合加热,将产生的气体通人酸性高锰酸钾溶液中 | 酸性高锰酸钾溶液褪色,证明乙醇发生消去反应生成乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com