
下列对化学反应热问题的说法正确的是( )
A.放热反应发生时不必加热
B.化学反应一定有能量变化
C.一般地说,吸热反应加热后才能发生
D.化学反应的热效应数值与参加反应的物质的多少无关
科目:高中化学 来源: 题型:
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转化技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料。
A.①③⑤ B.②③⑤
C.①②④ D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验装置用途正确的是
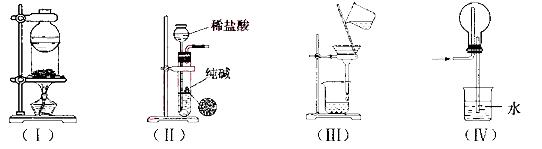
A.装置(I)用于I2与NH4Cl混合物的分离
B. 装置(Ⅱ)用于制取少量纯净的CO2气体
C.装置(III)用于去除Fe(0H)3胶体中含有的可溶性物质
D.装置(Ⅳ)用于HC1的吸收,以防倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知葡萄糖的燃烧热是ΔH=-2 840 kJ·mol-1,当它氧化生成1 g液态水时放出的热
量是( )
A.26.3 kJ B.51.9 kJ C.155.8 kJ D.467.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
比较下列各组热化学方程式中ΔH的大小关系。
(1)S(s)+O2(g)===SO2(g) ΔH1
S(g)+O2(g)===SO2(g) ΔH2
ΔH1______ΔH2
(2)CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH1
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH2
ΔH1______ΔH2
(3)煤作为燃料有两种途径:
途径1——直接燃烧
C(s)+O2(g)===CO2(g) ΔH1<0
途径2——先制水煤气
C(s)+H2O(g)===CO(g)+H2(g) ΔH2>0
再燃烧水煤气:
2CO(g)+O2(g)===2CO2(g) ΔH3<0
2H2(g)+O2(g)===2H2O(g) ΔH4<0
ΔH1、ΔH2、ΔH3、ΔH4的关系式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25°C、100 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+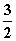 O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1 452 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.放热反应在常温下一定容易进行
B.植物的光合作用是把太阳能转化为热能的过程
C.反应是放热还是吸热是由反应物和生成物所具有的能量的相对大小决定的
D.凡是在加热或点燃条件下进行的反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二氧化硫的催化氧化的过程如图所示:
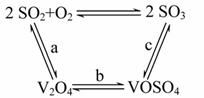
其中a、c二步的化学方程式可表示为____________
SO2+V2O5 SO3+V2O4
SO3+V2O4
4VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3
该反应的催化剂是__________(写化学式)。
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关 系如图所示:
系如图所示:
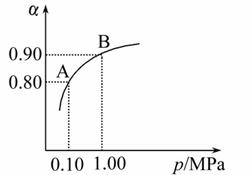
将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=_________。
2SO2+O2 在550 ℃时的平衡常数K=_________。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是_____________。
A.升高温度
B.充入He(g),使体系总压强增大
C.再充入2.0 mol SO2和1.0 mol O2
(4)维持温度不变条件下使之发生如下反应:
2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等,如图所示:

试填写下列空格:
A容器达到平衡时所需的时间比B容器___________(填“短”或“长”);平衡时A容器中SO2的转化率 比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
比B容器_________(填“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数__________(填“增大”“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com