
| A. | 可使用填埋法处理未经分类的生活垃圾 | |
| B. | 光化学烟雾的形成与汽车尾气中的氮氧化物有关 | |
| C. | 光导纤维都是有机高分子化合物 | |
| D. | “鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
科目:高中化学 来源: 题型:解答题
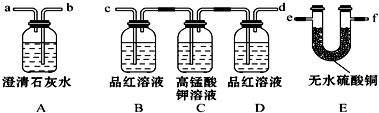
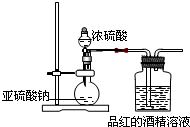
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCH2Cl2中含有C-Cl键数目为0.2NA | |
| B. | 常温常压下,3.0g尿素与乙酸的混合物,含氢原子总数为0.2NA | |
| C. | 常温常压下,10g92%酒精水溶液含氧原子总数为0.2NA | |
| D. | 常温常压下,0.1molNa2O2与水完全反应转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
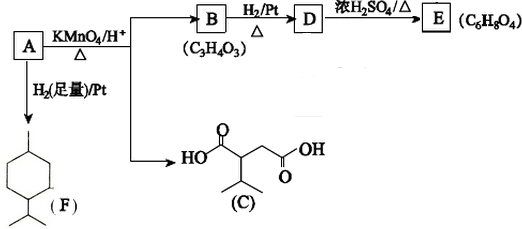
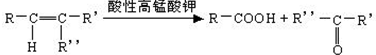
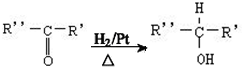
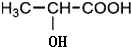 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$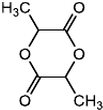 +2H2O.
+2H2O. ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①=④>③=② | B. | ①=④>③>② | C. | ①>④>③>② | D. | ④>①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟盐酸的反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铵固体和熟石灰共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向碳酸钙中加入盐酸 CO32-+2H+═H2O+CO2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应 Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- | |
| B. | PH=1的溶液中:K+、Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 新鲜的空气中:SO2、NO、N2、NH3 | |
| D. | 所有氯气的集气瓶中:H2S、H2、HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com