

分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)根据二氧化硫具有漂白性,能够使二氧化硫褪色反应;
(3)二氧化硫有毒,不能直接排放,需要用氢氧化钠溶液吸收;
(4)实验①证明了二氧化硫具有漂白性,实验②中高锰酸钾溶液褪色,证明二氧化硫具有还原性.
解答 解:(1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫具有漂白性,将二氧化硫通入品红溶液后,会观察到①中品红溶液褪色(或变浅),
故答案为:品红溶液褪色(或变浅);
(3)二氧化硫为有毒气体,多余的二氧化硫不能直接排放,所以装置③中氢氧化钠溶液的作用是吸收未反应的SO2,防止污染环境,
故答案为:吸收未反应的SO2,防止污染环境;
(4)装置①中品红溶液褪色,证明二氧化硫具有漂白性;装置②中酸性高锰酸钾具有强氧化性,二氧化硫能够使酸性高锰酸钾溶液褪色,证明了二氧化硫具有还原性,
硅答案为:漂白性、还原性.
点评 本题考查了二氧化硫的制取方法及化学性质,题目难度中等,明确二氧化硫的性质为解答关键,注意掌握二氧化硫的制备原理,试题培养了学生的化学实验能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题
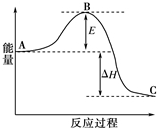 合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在X点时,由H2O电离出的c(H+)相等,c(M+)=c(R+) | |
| B. | 稀释前,c(ROH)=10c(MOH) | |
| C. | 稀释前的ROH与等体积pH=1的H2SO4混合后所得溶液显酸性 | |
| D. | 等体积等浓度的MOH和HCl混合后,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气反应生成一氯甲烷 | B. | 苯与氢气反应生成环己烷 | ||
| C. | 乙烯与溴反应生成1,2-二溴乙烷 | D. | 乙醇与氧气反应生成乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 用途 |
| A | 氧化铁呈红棕色 | 红色涂料 |
| B | 氧化铝熔点很高 | 耐火材料 |
| C | 浓硫酸具有脱水性 | 干燥剂 |
| D | 液氨汽化时要吸收大量的热 | 制冷剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
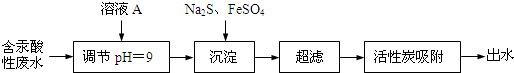
| 离子 | Na+ | Fe2+ | Cl- | SO42- |
| 浓度(mol/L) | 3.0×10-4 | 2.0×10-4 | 2.5×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com