
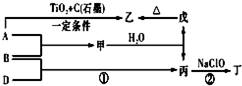
 ��֪ A��B��DΪ��ѧ�����ĵ��ʣ��ס��ҡ�����������Ϊ������Ԫ����ɵĻ�������У�����һ����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壻����һ�ָ���ȼ�ϣ������Ԫ�������ͬ��1mol �������в�ͬԭ�ӵ���Ŀ��Ϊ1��2���Һ���18mol���ӣ�����һ��������ˮ�İ�ɫ��״���ʣ�������ǿ�ᷴӦ��Ҳ����ǿ�Ӧ�����о�ˮ���ã������ʼ��ת����ϵ��ͼ��ʾ��ijЩ��������ȥ����
��֪ A��B��DΪ��ѧ�����ĵ��ʣ��ס��ҡ�����������Ϊ������Ԫ����ɵĻ�������У�����һ����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壻����һ�ָ���ȼ�ϣ������Ԫ�������ͬ��1mol �������в�ͬԭ�ӵ���Ŀ��Ϊ1��2���Һ���18mol���ӣ�����һ��������ˮ�İ�ɫ��״���ʣ�������ǿ�ᷴӦ��Ҳ����ǿ�Ӧ�����о�ˮ���ã������ʼ��ת����ϵ��ͼ��ʾ��ijЩ��������ȥ����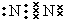 ��д�����Ľṹʽ
��д�����Ľṹʽ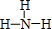 ��
������ A��B��DΪ��ѧ�����ĵ��ʣ��ס��ҡ�����������Ϊ������Ԫ����ɵĻ��������һ����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壬���ΪNH3������һ�ָ���ȼ�ϣ������Ԫ�������ͬ��1mol�������в�ͬԭ�ӵ���Ŀ��Ϊ1��2���Һ���18mol���ӣ���ΪN2H4������һ��������ˮ�İ�ɫ��״���ʣ�������ǿ�ᷴӦҲ����ǿ�Ӧ�����о�ˮ���ã�����ΪAl��OH��3�����ת����ϵͼ��֪����ΪAl2O3��AΪAl��BΪN2����Ϊ��������DΪH2���ݴ˽��
��� �⣺A��B��DΪ��ѧ�����ĵ��ʣ��ס��ҡ�����������Ϊ������Ԫ����ɵĻ��������һ����ʹʪ��ĺ�ɫʯ����ֽ��������ɫ���壬���ΪNH3������һ�ָ���ȼ�ϣ������Ԫ�������ͬ��1mol�������в�ͬԭ�ӵ���Ŀ��Ϊ1��2���Һ���18mol���ӣ���ΪN2H4������һ��������ˮ�İ�ɫ��״���ʣ�������ǿ�ᷴӦҲ����ǿ�Ӧ�����о�ˮ���ã�����ΪAl��OH��3�����ת����ϵͼ��֪����ΪAl2O3��AΪAl��BΪN2����Ϊ��������DΪH2��
��1������BΪN2������ʽΪ��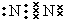 ����ΪNH3���ṹʽΪ��
����ΪNH3���ṹʽΪ��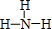 ��
��
�ʴ�Ϊ��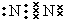 ��
��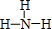 ��
��
��2������ǿ�Ӧ�����ӷ���ʽ��Al��OH��3+OH-=AlO2-+2H2O��
�ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��
��3����ΪN2H4��Nԭ��֮���γɷǼ��Լ���Nԭ����Hԭ��֮���γɼ��Լ���
�ʴ�Ϊ��BC��
��4�����õ�����H2Ϊԭ�ϡ���H+�Ĺ�������������ʣ��ڳ�ѹ����H2����He��ϡ�͵ĵ����ֱ�ͨ����ص������������ɲ���������ĵ缫�ϵĵ缫��ӦʽΪ��N2+6H++6e-=2NH3����һ���缫����H2-2e-=2H+��ʧȥ���ӵķ�Ӧ��������Ӧ��
�ʴ�Ϊ��N2+6H++6e-=2NH3��������Ӧ��
��5����Ӧ��Ϊ������NaClO�ķ�Ӧ��0.5molNaClO�μӷ�Ӧʱ��ת��1mol���ӣ���ClԪ����+1�۽���Ϊ-1�ۣ��÷�Ӧ����NaCl��ͬʱ����N2H4��ˮ����÷�ӦΪ2NH3+NaClO�TN2H4+NaCl+H2O��
�ʴ�Ϊ��2NH3+NaClO�TN2H4+NaCl+H2O��
��6��һ�������£�Al��TiO2��C��ʯī����Ӧֻ����Al2O3��̼���ѣ�TiC����������Ӧ��4Al+3TiO2+3C��ʯī��$\frac{\underline{\;һ������\;}}{\;}$2Al2O3+3TiC���÷�Ӧ����1molAl2O3ʱ�ų�536kJ���������Ȼ�ѧ����ʽΪ��4Al��s��+3TiO2��s��+3C��s��ʯī��=2Al2O3��s��+��s��+3TiC��s����H=-1072KJ/mol��
�ʴ�Ϊ��4Al��s��+3TiO2��s��+3C��s��ʯī��=2Al2O3��s��+��s��+3TiC��s����H=-1072KJ/mol��
���� ���⿼��Ԫ�ؼ���������ƶϡ����ʵĵ���ʽ���ṹʽ����д����ѧ����ʽ���Ȼ�ѧ����ʽ����д��ȼ�ϵ�ص缫��Ӧʽ����д��֪ʶ��������ѧ���ķ��������Ŀ��飬������Ϊ�ƶϵ�ͻ�ƿڣ���Ҫѧ����������Ԫ�ػ��������ʣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H3+2��H1+2��H2 | B�� | ��H3+2��H1+��H2 | C�� | ��H3+2��H1-��H2 | D�� | ��H3+2��H1-2��H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ��ⶨ������ |
| �� | �ⶨ������H2����� |
| �� | ���ⶨ��������þ���������ⶨ��Ӧ���Ļ�ʣ���NaOH�������ⶨ���ɵ�NaAlO2������ |
| ʵ����� | Ԥ������ͽ��� |
| ����1�� | |
| ����2�� | |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ŀ���ʴ����������ǿ | |
| B�� | ���þƾ�ϴ�Ӹ������Թ��ڱ��ϵĹ�̬�� | |
| C�� | �ö��Ե缫�������NaCl�ɻ�ý����� | |
| D�� | ������������NaOH��Һ��Ӧ������ʢ�ż�Һ���Լ�ƿ������ĥ�ڲ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3.5��10-3 g | B�� | 7��10-4 g | C�� | 4.52��10-3 g | D�� | 4.52��10-2 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
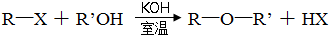 ��
��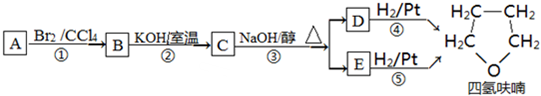
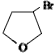 ��D
��D ��E
��E ��
��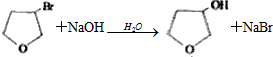 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol•L-1 | B�� | 0.3 mol•L-1 | C�� | 0.5 mol•L-1 | D�� | 0.15 mol•L-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com