
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:
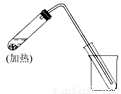
(1)左边大试管中要加入几片碎瓷片,其作用是_________________________________;
(2)该装置中使用的玻璃导管较长,其作用是____________________________________;
(3)烧杯中还要盛有的物质是________________。
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:填空题
KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:

(1)试剂c的化学式是_______,固体1的化学式是________。加入过量K2CO3所发生反应的化学方程式为__________。
(2)结合下图各物质的溶解度曲线可知操作③的名称是______、__________。
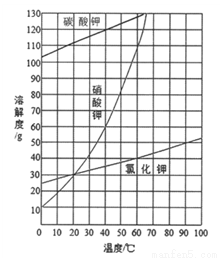
有同学认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该同学的观点是否正确?并做出相应解释_____________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省榆林市高考模拟第一次测试理综化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值。下列说法正确的是
A. 100mL12mol/L浓盐酸与足量MnO2共热,转移的电子数为0.6NA
B. 1mol/L的NaClO溶液中含有ClO-的数目为小于NA
C. 标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为NA
D. O2和O3的混合物共3.2g,其中所含氧原子数一定为0.2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1 HBr溶液和20.00 mL0.1000 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示,下列说法不正确的是( )

A. 根据图1和图2判断,滴定HBr溶液的曲线是图1
B. a=20.00 mL
C. c(Na+)=c(CH3COO-)的点是B点
D. E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
常温下,将少量水加入下列物质中,相关量变化正确的是
A. AgCl悬浊液中 c(Cl-)变小 B. 0.1mol/LCH3COOH溶液中 c(H+)变小
C. 0.1mol/LNa2CO3c(HCO3-)变大 D. 0.1mol/LNH4Cl溶液中 n(OH-)变小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
下列溶液中c(Cl-)与50 mL 1 mol/L AlCl3溶液中c(Cl-)相等的是( )
A. 150 mL 1 mol/L的NaCl溶液 B. 75 mL 2 mol/L的NH4Cl溶液 C. 150 mL 2 mol/L的KCl溶液 D. 75 mL 1 mol/L的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。不正确的操作顺序是
A. ①④②⑤③ B. ⑤④②①③ C. ②⑤④①③ D. ⑤②④①③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高二上学期期末考试(理)化学试卷(解析版) 题型:选择题
工业上常利用CO与SO2反应生成固态S单质和CO2,从而消除这两种气体对大气的污染:2CO(g)+SO2(g) 2CO2(g)+S(s) ΔH=-a kJ/mol(a>0),下列叙述正确的是
2CO2(g)+S(s) ΔH=-a kJ/mol(a>0),下列叙述正确的是
A. 该反应的平衡常数表达式为
B. 若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ
C. 增大压强或升高温度都可以加快化学反应速率并提高SO2的转化率
D. 若单位时间内生成2 mol CO2,同时消耗1 mol SO2,则说明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三第二次质检化学试卷(解析版) 题型:简答题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3•CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.从废料中回收氧化钴(CoO)的工艺流程如下:
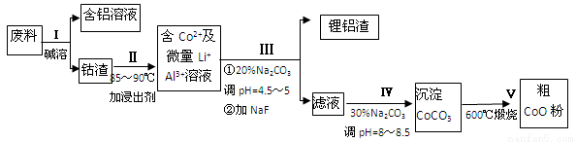
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为 (产物中只有一种酸根).请从反应原理分析不用盐酸浸出钴的主要原因 .
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com