
【题目】某校高一研究性学习小组将造成我省某市空气污染的主要原因分为以下四种:
A. 燃烧农作物秸秆 B.燃烧含硫煤 C.粉尘污染 D.机动车尾气污染
并就造成该市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示:
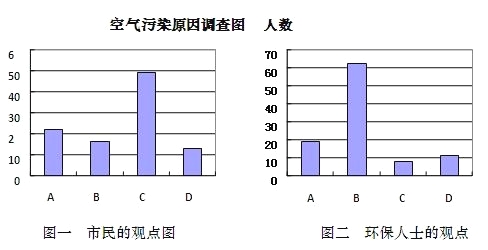
(1)调查结果显示:该市市民认为造成空气污染的最主要原因是___,环保人士认为造成该市空气污染的最主要原因是____。
(2)调查结果说明市民对造成空气污染的最主要原因认识不足。该最主要原因造成的大气污染的主要有害成分是_______,空气中该成分含量较高时,在空气中的氧气和水的共同作用下,会形成酸雾,其化学反应方程式为_________________________________
(3)下列措施能够减少空气中该成分排放量的是______________
①用天然气代替煤炭做民用燃料 ②改进燃烧技术,提高热能利用率 ③工厂生产时将燃煤锅炉的烟囱造得更高 ④燃煤中加入适量石灰石后使用
【答案】C B SO2 2SO2+O2+2H2O=2H2SO4 ①②④
【解析】
(1)从图表知该市市民认为造成空气污染的最主要原因是粉尘污染,环保人士认为造成该市空气污染的最主要原因是燃烧含硫煤;
(2)燃烧含硫煤产生的大气污染的主要有害成分为SO2,SO2在空气中的氧气和水的共同作用下,会形成酸雾,反应的化学方程式为2SO2+O2+2H2O=2H2SO4;
(3)①天然气中的含硫量较煤少,用天然气代替煤炭做民用燃料能够减少SO2的排放;②改进燃烧技术可减少二氧化硫的排放;③工厂生产时将燃煤锅炉的烟囱造得更高,不能减少SO2的排放;④燃煤中加入适量石灰石可起到固硫作用,减少SO2的排放;故选①②④。


科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属Cu。根据流程图,下列说法不正确的是
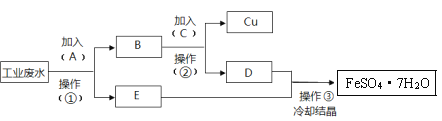
A.①②操作均为过滤,但D、E溶液成分不完全相同
B.C可以为稀硫酸,也可以是稀盐酸
C.操作③采用冷却结晶,说明硫酸亚铁晶体的溶解度随温度变化有一定变化
D.A为足量铁粉,其反应的离子方程式为:Fe+Cu2+=Fe2++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C. 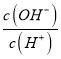 =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是( )
A.C2H5Cl、CH3CH2ClB.OH﹣、![]()
C.![]() 、
、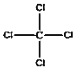 D.C2H6O、CH3CH2OH
D.C2H6O、CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
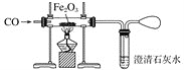
(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充满液体
④调节液面至“0”或“0”刻度线稍下,并记下读数
④移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数。
填空:(1)以上步骤有错误的是(填编号)_________,该错误操作会导致测定结果__________。(填“偏大”、“偏小”或“无影响”)
(2)步骤⑤中,在记录滴定管液面读数时,滴定管尖嘴有气泡,导致测定结果____________。(填“偏大”、“偏小”或“无影响”)
(3)判断滴定终点的现象是:___________________________________;
(4)如下图是某次滴定时的滴定管中的液面,其读数为_________mL

(5)根据下列数据:请计算待测盐酸溶液的浓度:_______________________mol·L-1
滴定次数 | 待测液体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-测定的基本原理是将其氧化成I2,再用Na2S2O3标准溶液来滴定。如果样品中仅含有微量I-,必须用“化学放大”反应将碘的量“放大”,然后再进行测定。下面是化学放大反应的实验步骤:
I.将含有微量I-的样品溶液调至中性或弱酸性,加入溴水,将I-完全氧化成IO![]() ,煮沸去掉过量的溴;
,煮沸去掉过量的溴;
Ⅱ.取上述溶液,加入过量硫酸酸化的KI溶液,振荡,溶液颜色呈棕黄色;
Ⅲ.将Ⅱ所得溶液中全部的I2萃取至CCl4中;
Ⅳ.向分液后的CCl4溶液中加入肼(N2H4)的水溶液,产生无毒的N2,分去有机层;
V.将Ⅳ所得水溶液重复I、Ⅱ步骤;
Ⅵ.以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。已知:反应为:I2+2S2O![]() =2I-+S4O
=2I-+S4O![]() ;Na2S2O3和Na2S4O6溶液颜色均为无色。
;Na2S2O3和Na2S4O6溶液颜色均为无色。
(1)I中氧化剂和还原剂物质的量之比为______。
(2)Ⅲ中使用的主要玻璃仪器是______(填名称)。
(3)Ⅳ中反应的离子方程式是______。
(4)Ⅵ中需要在中性或弱酸性环境中进行,pH过大,Na2S2O3易被I2氧化成Na2SO4,其离子方程式为_______;结合离子方程式解释pH不宜过小的原因:______。VI中滴定终点的现象是______。
(5)样品中I-最终所消耗的Na2S2O3的物质的量与样品中初始I-物质的量的比值称为“放大倍数”。经过以上操作,放大倍数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com