
| ||


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
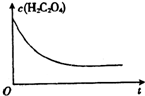 某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.
某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色所需时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 4 | ||
| 3 | 60 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
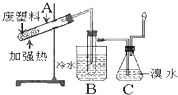 加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用.下列叙述不正确的是( )
加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用.下列叙述不正确的是( )| A、丙烯分子中共用电子对数为10 |
| B、装置B的试管中可收集到芳香烃 |
| C、装置C中的试剂可吸收烯烃以制取卤代烃 |
| D、最后收集的气体可做燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用热的纯碱可除去炊具上的油污 |
| B、福尔马林可制备标本是利用了使蛋白质变性的性质 |
| C、含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火 |
| D、红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com