
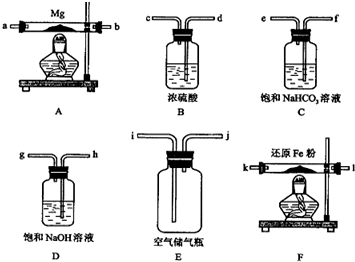
| 装置 | 目的 |
分析 本题是在实验室里利用空气和镁粉为原料制取少量纯净的氮化镁,为了保证产品的纯度,需要除去空气中的氧气、二氧化碳及水气,分别利用还原铁粉、氢氧化钠溶液及浓硫酸完成,产品的检验可利用氮化镁的性质⑤来设计实验操作.
(1)根据题中信息可知Mg在空气中点燃可以和O2、CO2、H2O反应,所以镁和氮气反应必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2,浓硫酸作用是除去水蒸气,浓氢氧化钠是除去空气中二氧化碳,灼热的铁粉为了除去空气中氧气;
(2)根据先除杂后干燥的原理及固体加热试管必须干燥的原理可将装置进行排序.气体参与的物质制备实验中装置的连接一般顺序是:制备气体→除杂→干燥→制备→尾气处理;
(3)通气后,先排除空气中的杂质,所以应该先点燃F;因为A装置没有排完空气前就加热会让空气中的氧气、CO2、水蒸气等与镁反应,如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁;
(4)取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成.
解答 解:(1)根据题中信息可知Mg在空气中点燃可以和O2、CO2、H2O反应,所以镁和氮气反应必须将空气中的O2、CO2、H2O除去制得干燥纯净的N2,浓硫酸作用是除去水蒸气,浓氢氧化钠是除去空气中二氧化碳,灼热的铁粉为了除去空气中氧气;所以在设计实验方案时,除装置A、E外,还应选择的装置B,目的是除气流中的水蒸汽,避免反应④发生;D,目的是除去空气中的CO2,避免反应③发生;F,目的是除去空气中的氧气,避免反应①发生,
故答案为:
| 装置 | 目的 |
| B | 目的是除气流中的水蒸汽,避免反应④发生 |
| D | 目的是除去空气中的CO2,避免反应③发生 |
| F | 目的是除去空气中的氧气,避免反应①发生 |
点评 本题考查了物质制备原理和装置选择,实验步骤的设计分析判断、物质性质的应用是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液与NaOH溶液反应:HSO3-+OH-═SO32-+H2O | |
| B. | 少量二氧化碳通入足量的NaOH溶液:CO2+2OH-═CO32-+H2O | |
| C. | Ba(OH)2与H2SO4反应:H++OH-═H2O | |
| D. | 氨水和醋酸溶液混合:NH3•H2O+CH3COOH═NH4++CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
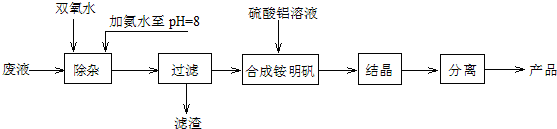
 .
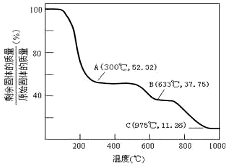
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
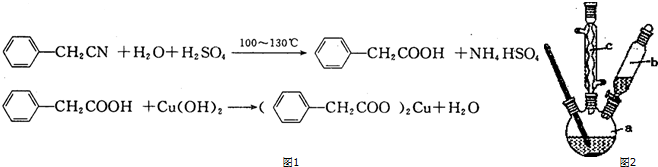
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com