

分析 (1)铁在冷的浓硫酸中发生钝化,表面形成致密的氧化膜;
(2)亚铁离子有还原性,能还原酸性高锰酸钾溶液而使其褪色;根据硫酸钡与二氧化硫的关系式计算二氧化硫的体积,再根据体积分数公式计算;
(3)二氧化硫能使品红溶液褪色,据此判断是否含有二氧化硫;
(4)碳素钢中含有碳,加热条件下,碳和浓硫酸反应生成二氧化碳;
(5)用澄清石灰水检验二氧化碳,首先要排除二氧化硫的干扰.
解答 解:(1)常温下,铁遇冷的浓硫酸发生氧化还原反应,在铁表面生成一层致密的氧化物薄膜而阻止了进一步的反应,即发生钝化现象,所以反应片刻后取出观察,铁钉表面无明显变化,故答案为:铁钉表面被钝化;
(2)①金属铁可以和铁离子之间反应生成亚铁离子2Fe3++Fe=3Fe2+,金属铁可以和酸之间反应生成亚铁离子Fe+2H+=Fe2++H2↑,亚铁离子具有还原性,而酸性高锰酸钾有氧化性,发生氧化还原反应使高锰酸钾溶液褪色,故答案为:2Fe3++Fe=3Fe2+(或Fe+2H+=Fe2++H2↑);D;
②SO2+Br2+2H2O=2HBr+H2SO4,H2SO4+BaCl2=BaSO4↓+2HCl,
所以硫酸钡和二氧化硫之间的关系式为SO2~BaSO4,设二氧化硫的体积为V,
SO2~BaSO4,
22.4L 233g
V 4.66g
V=0.448l=448mL,所以二氧化硫的体积分数=$\frac{448mL}{560mL}$×100%=80%,
故答案为:80%;
(3)二氧化硫能使品红溶液褪色,所以用品红溶液检验二氧化硫是否除尽,故答案为:检验SO2是否除尽;
(4)碳素钢中含有碳,加热条件下,碳能和浓硫酸反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(5)二氧化硫和二氧化碳都能使澄清石灰水变浑浊,但二氧化硫还能使品红溶液褪色,所以要检验二氧化碳必须排除二氧化硫的干扰,B装置是检验二氧化硫是否除尽,所以澄清石灰水应放置在B和C之间,即在通入碱石灰之前检验,故答案为:C.
点评 本题考查了浓硫酸的性质、二氧化硫的性质、常见物质的检验等知识点,侧重于考查学生综合运用化学知识的能力和实验能力,注意常温下,铁和冷的浓硫酸不是不反应,而是反应生成了致密的氧化物薄膜而阻止了进一步反应,为易错点.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
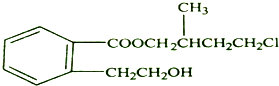
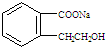 .
.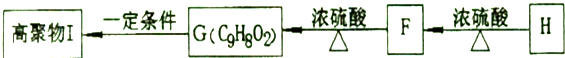
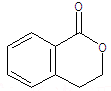 .②由F生成的G化学方程式
.②由F生成的G化学方程式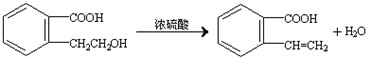 .
.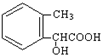 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子和阴离子数目一定相等 | |
| B. | 阳离子带的正电荷总数一定等于阴离子所带的负电荷总数 | |
| C. | 除阴、阳离子外溶液中不会再有其它粒子 | |
| D. | 强电解质溶液的导电性一定强于弱电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeCl3溶液与Cu粉反应:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的体积和体系的压强 | B. | 溶液颜色的深浅 | ||
| C. | 固体物质的体积 | D. | H+浓度的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
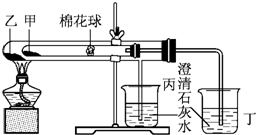 下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:
下列是某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验.请观察下图的实验装置,分析实验原理,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com