
【题目】下列自然资源的开发利用过程中只涉及了物理变化的是
A.海水晒盐B.伐薪烧炭C.煤炭发电D.刀耕火耨
科目:高中化学 来源: 题型:
【题目】FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是__________________________________________________。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)______________________________。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2 mol·L-1, c(Fe3+)=1.0×10-3 mol·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为________。
②完成NaClO3氧化FeCl2的离子方程式:
![]() ClO3-+
ClO3-+![]() Fe2++________===
Fe2++________===![]() Cl-+
Cl-+![]() Fe3++
Fe3++![]() ________,______________
________,______________
(3)FeCl3在溶液中分三步水解:
Fe3++H2O ![]() Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O![]() Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++H2O![]() Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是________________。
通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)
Fex(OH)![]() +yH+,欲使平衡正向移动可采用的方法是(填序号)________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)________。
a.降温 b.加水稀释
c.加入NH4Cl d.加入NaHCO3
(4)天津某污水处理厂用聚合氯化铁净化污水的结果如图所示。由图中数据得出每升污水中投放聚合氯化铁[以Fe(mg·L-1)表示]的最佳范围约为________mg·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从氧化还原角度分析,下列反应中水的作用相同的是
① 铁和水蒸气反应 ② 过氧化钠和水反应
③氯气和水反应 ④ 二氧化氮和水反应3NO2+H2O=2HNO3+NO
A.①②③B.①②④C.②③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子数总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7:8;E与B的质量比为1:1。试回答:
(1)写出基态D原子的电子排布式_______________________。
(2)用电子式表示AE2的形成过程_______________,与AE2互为等电子体的离子是_______。
(3)相同条件下EB2分子和AB2分子两者在水中的溶解度较大的是____(写分子式),理由是
______________________________。
(4)根据VSEPR模型预测C的氢化物的立体结构为_________,B、C两元素的气态氢化物的稳定性大小关系为:_____________(填写化学式)。
(5)C的单质中π键的数目为___,晶体D的晶胞中的所含原子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中存在大量的Ba2+、NH4+、Cl-,该溶液中还可能大量存在的离子是( )
A. Fe3+B. CO32-C. Mg2+D. OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表格中各项分类都正确的一组是
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 生铁 | 黄铜 | 液态氯化氢 | SO2 |
B | 硫酸钠 | 水银 | 石墨 | 食盐水 |
C | 洁净的空气 | 盐酸 | CuSO4溶液 | 蔗糖 |
D | 氢氧化钠 | 澄清石灰水 | AgCl | CO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题:
(1)氨气的制备

①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为____________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______,______→_____→i(按气流方向,用小写英文字母表示)。
③可用如装置进行氨的喷泉实验,引发喷泉的操作是__________。

(2)如图所示,NH3经一系列反应可以得到HNO3。

①反应①的化学方程式为________________________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式为_______________________。
(3)在某100mL硝酸与硫酸的混合液中,HNO3和H2SO4的物质的量浓度分别为0.6 mol·L-1和0.3mol·L-1。向该混合液中加入3.84g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是多少____________?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
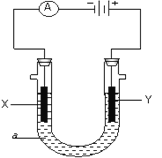
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则可观察到在X极附近观察到的现象是__________电极反应式是________________检验Y电极反应产物的方法是____________________电解一段时间之后溶液的PH将会________(升高、降低或不变),总方程式为_________________________。
(2)若X、Y都是铜电极,a是稀CuSO4溶液,开始实验,X极的电极反应式是__________________________。电解前后CuSO4溶液的浓度___________________(变大、变小或不变)若X电极质量增重64克,则在电路中有_________________mol的电子发生转移。
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是_____,电极反应式是_____________。②Y电极的材料是______,电极反应式是____________________。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的各字母表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A是金属单质;B是淡黄色固体; C、D、E为无色气体,D能使湿润的红色石蕊试纸变蓝;H是无色液体。

(1)写出下列各物质的化学式:
B:____________________________;F:_______________________ 。
(2)写出D→E反应的化学方程式为:______________________ 。
(3)写出G→E反应的离子方程式:________________________________ ;若该反应中转移电子总数为9.03 ×1023 ,则被还原的G为___________________ g 。
(4)写出实验室制取D的化学方程式________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com