

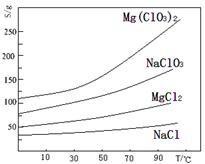


科目:高中化学 来源:不详 题型:填空题
| A.用25mL碱式滴定管量取20.00mLNaHCO3 |
| B.用托盘天平准确称量10.20克碳酸钠固体 |
| C.用100mL量筒量取3.2mL浓硫酸 |
| D.配制1 mol·L–1的氢氧化钠溶液475mL选用500mL容量瓶 |
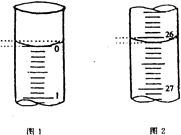
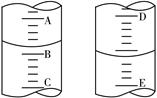
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
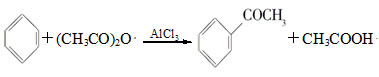
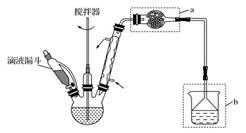
| A.反应太剧烈 | B.液体太多搅不动 | C.反应变缓慢 | D.副产物增多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出。 |
| B.蒸馏时,温度计水银球应浸没在液体中。 |
| C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出。 |
| D.把几滴FeCl3饱和溶液滴入250mL的沸水中制取Fe(OH)3胶体。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
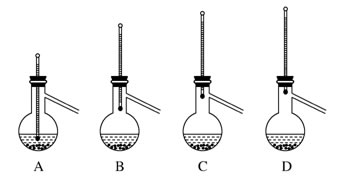
| A.称量氢氧化钠固体质量时,先在两个托盘上各放一张相同质量的纸,再放氢氧化钠 |
| B.在烧杯中溶解固体NaOH,完全溶解后立即将其转移至容量瓶中 |
| C.过滤和配制一定物质的量浓度的溶液时,都需要用玻璃棒进行液体的引流 |
| D.从NaCl溶液中获取晶体时,应将蒸发皿中NaCl溶液全部加热蒸干 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 |
| B.判断CuO和MnO2对H2O2分解的催化效率,可通过比较H2O2溶液析出气泡的快慢程度,或测定单位时间内产生氧气的体积 |
| C.食醋总酸含量测定实验中,实验结束时碱式滴定管尖嘴部位有气泡,则测定的醋酸含量偏高 |
| D.将硫酸亚铁和硫酸铵的混合溶液加热浓缩,冷却结晶后可析出摩尔盐粗产品,再用酒精洗去晶体表面的水分,加热烘干后称重,计算产率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
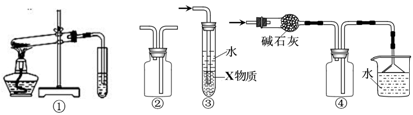
| A.装置①可用于探究NH4HCO3的热稳定性 |
| B.装置②可用于收集H2、CO2 |
| C.装置③中X若为CCl4,可用于吸收氨气或氯化氢,并能防倒吸 |
| D.装置④可用于干燥、收集NH3,并吸收多余的氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com