
| 试剂 温度 | T1/℃ | T2/℃ | T3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
分析 (1)碳酸钠为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性;
(2)根据溶解度分别求出10mL水(20℃)分别溶解的Na2CO3、NaHCO3固体与0.5g作比较分析;
(3)分析表1的数据得出:T1/℃,Na2CO3固体溶于水温度升高,NaHCO3固体溶于水温度降低;
(4)需探究盐酸溶于水温度的变化;
(5)A.分析表1的数据得出NaHCO3与盐酸的反应是吸热反应;
B.Na2CO3和NaHCO3固体二者与酸反应的快慢不同;
C.从温度变化可判别Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关.
(6)根据质量守恒定律,由加热前后剩余物质的质量差可求得分解反应出二氧化碳与水的质量即固体减少的质量,由固体减少的质量根据化学方程式计算出样品中碳酸氢钠质量,并进一步计算样品中碳酸氢钠的质量分数.
解答 解:(1)碳酸钠为强碱弱酸盐,钠离子不水解、碳酸根离子水解导致溶液呈碱性,水解离子方程式为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-;
(2)10mL水(20℃)溶解Na2CO3固体质量为:m=$\frac{10mL}{100mL}$×21.5g=2.15g>0.5g,10mL水(20℃)溶解NaHCO3固体质量为:m=$\frac{10mL}{100mL}$×9.6g=0.96g>0.5g,0.5gNa2CO3、NaHCO3固体都是全部溶解,
故答案为:Na2CO3、NaHCO3固体都是全部溶解;
(3)分析表1的数据得出:T1/℃,Na2CO3固体溶于水温度从20℃升高到23.3℃,放热,NaHCO3固体溶于水温度从20℃升高到18.5℃,吸热,
故答案为:放热;吸热;
(4)强酸溶于水放热,盐酸为强酸,所以需增加探究盐酸溶于水温度的变化,即10mL密度约为1.1g/mL20%的盐酸搅拌,测量温度为22.2℃,
故答案为:密度约为1.1g/mL20%的盐酸;
(5)A.盐酸溶于水放热,测量温度为22.2℃,T1/℃,NaHCO3固体溶于水温度从20℃升高到18.5℃,吸热,两者反应恒温后测量温度T3为20.8℃低于22.2℃,所以NaHCO3与盐酸的反应是吸热反应,故A正确;
B.用稀盐酸鉴别NaHCO3和Na2CO3溶液,反应较快的为NaHCO3,能鉴别,故B错误;
C.从上述温度变化数值可判别Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关,故C正确.
故选AC;
(6)设样品中碳酸氢钠的质量为x.
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O↑+CO2↑ 固体质量减少
168 106 168-106=62
x m1-m2
$\frac{168}{62}$=$\frac{x}{m_{1}-m_{2}}$ x=$\frac{84(m_{1}-m_{2})}{31}$样品中碳酸氢钠的质量分数=$\frac{84(m_{1}-m_{2})}{31m_{1}}$×100%
故答案为:$\frac{84(m_{1}-m_{2})}{31m_{1}}$×100%.
点评 本题以Na2CO3和NaHCO3为载体考查物质的性质实验,为高考常见题型,侧重于学生的分析能力和实验能力的考查,抓住题干信息以及Na2CO3和NaHCO3的性质是解答本题的关键,注意物质性质的差异,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 化学事实 | 类推结论 | |
| A | 常温下,pH=3的盐酸稀释1000倍后pH=6 | 常温下,pH=6的盐酸稀释1 000倍后pH=9 |
| B | 电解熔融MgCl2可制取金属镁 | 电解熔融AlCl3也可制取金属铝 |
| C | Na着火不能用干冰灭火 | K着火也不能用干冰灭火 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论解释 | |
| A | 过量铁粉加稀硝酸充分反应,滴入KSCN溶液 | 产生红色溶液 | 稀HNO3将铁氧化成Fe3+ |
| B | 某实验小组从资料上获得信息:Fe3+可以氧化银单质.他们用这种方法清洗一批作了银镜反应的试管,配制了Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗实验. | 用FeCl3溶液清洗比Fe2(SO4)3溶液清洗得干净 | 他们认为Fe3+氧化银单质的过程可能是一个可逆过程:Fe3++Ag?Fe2++Ag+ |
| C | 苯酚钠溶液中通入少量CO2气体 | 溶液变浑浊 | 碳酸酸性强于苯酚,溶液中还有Na2CO3生成 |
| D | 相饱和碳酸钠溶液通过量CO2气体 | 产生沉淀 | 因为析出Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
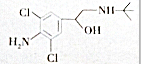
| A. | 该物质含有苯环,属于芳香族化合团 | |
| B. | 该物质只含有-OH,-NH2两种官能团 | |
| C. | 该物质含有-OH,就具有-OH的性质 | |
| D. | 该物质能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
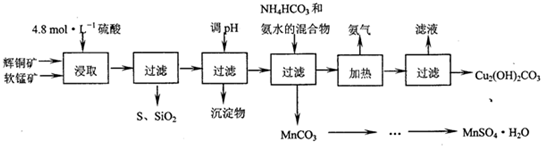
| 开始沉淀的PH | 沉淀完全的PH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
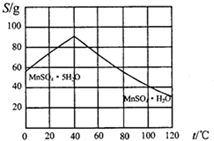
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
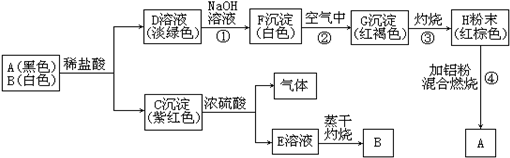
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com