
分析 Ⅰ.(1)高锰酸钾溶液颜色为紫红色,可不用加入指示剂;
(2)酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管,无色NaHSO3溶液显酸性,用酸式滴定管,滴定过程还需要烧杯、锥形瓶、白纸、滴定管夹和铁架台;
(3)高锰酸钾具有强氧化性能腐蚀碱式滴定管中的橡胶管;
(4)滴定后俯视液面,读数偏小;根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$×$\frac{5}{2}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
Ⅱ.Ce(OH)4产品加硫酸溶解后,Ce(OH)4溶解成Ce4+,和FeSO4发生反应:Ce4++Fe2+=Ce3++Fe3+,由原子守恒知n(Ce(OH)4)=n(Ce4+)=n(FeSO4)可以解得Ce(OH)4产品中Ce(OH)4的质量,产品中Ce(OH)4的质量分数=$\frac{m(Ce(OH)_{4})}{m(样品)}$×100%.
解答 解:(1)高锰酸钾溶液颜色为紫红色,滴定终点时,溶液由无色变为红色,不用指示剂,当最后一滴溶液滴入,溶液的紫色退去,且30s内不复现,可达到滴定终点,
故答案为:不需要 Mn2+无色,MnO4- 为紫色,过量的MnO4-使无色溶液变为紫色;
(2)酸性高锰酸钾具有强氧化性,实验时应用酸式滴定管,无色NaHSO3溶液显酸性,用酸式滴定管,滴定过程还需要锥形瓶盛放待测液、白纸对比终点颜色变化、滴定管夹和铁架台,所以需要用到的是:A、D、E、F(G、H),
故答案为:A、D、E、F(G、H);
(3)高锰酸钾具有强氧化性能腐蚀碱式滴定管中的橡胶管,所以不用用碱式滴定管盛放高锰酸钾溶液,应该用酸式滴定管;
故答案为:碱;酸性KMnO4溶液会腐蚀碱式滴定管下端胶管;
(4)滴定前平视KMnO4液面,刻度为a mL,滴定后俯视液面刻度为b mL,读数偏小,则(b-a)mL比实际消耗KMnO4溶液体积少,如果滴定后仰视液面刻度为cml,测定标准溶液的体积会增大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$×$\frac{5}{2}$分析,c(待测)偏大,
故答案为:少;大.
Ⅱ.Ce(OH)4产品加硫酸溶解后,Ce(OH)4溶解成Ce4+,和FeSO4发生反应:Ce4++Fe2+=Ce3++Fe3+,由原子守恒知n(Ce(OH)4)=n(Ce4+)=n(FeSO4)=0.1000mol•L-1×0.02000L=0.002000mol;m(Ce(OH)4)=n(Ce(OH)4)×M(Ce(OH)4)=0.002000mol×209g•mol-1=0.418g
该产品中Ce(OH)4的质量分数=$\frac{m(Ce(OH)_{4})}{m(样品)}$×100%=$\frac{0.418g}{0.50g}$×100%=83.20%,
故答案为:.83.20%.
点评 本题考查中和滴定知识以及误差分析、含量测定计算,侧重于学生的分析能力、实验能力的考查,注意把握实验的方法和操作,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该星球表面温度很高 | |
| B. | 该星球表面温度很低 | |
| C. | 低温下稳定性CH2=CHOH>CH3CHO | |
| D. | 该反应中CH2=CHOH化学键断裂吸收能量大于CH3CHO化学键形成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(l);△H1 2H2(g)+O2(g)=2H2O(g);△H2 | |
| B. | S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g)△H2 | |
| C. | H2(g)+Cl2(g)=2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g);△H2 | |
| D. | C(s)+$\frac{1}{2}$O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
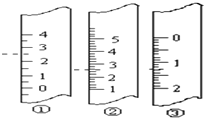 某同学用0.10mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
某同学用0.10mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Na2S2O3起始读数 | Na2S2O3 终点读数 | |
| 第一次 | 0.10mL | 18.30mL |
| 第二次 | 0.30mL | 18.30mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的电子排布图: | B. | Na+的结构示意图: | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化电子排布式:[Ne]3s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com