
某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8000 mg/L~10000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用,切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉处保存。请完成以下实验探究过程:
(一)阅读材料,获取信息
(1)推测该消毒液的酸碱性:________,原因是(用离子方程式表示)________。
(2)该消毒液还具有的化学性质是________性和________性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是________。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
(三)实验探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯中浸泡一段时间,对可能产生的现象有如下假设:假设①:有明显现象;假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是________。
(5)基于假设②,结论是________,请设计实验进一步验证该结论,叙述实验操作:
________。
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
已知:4NH3(g)+5O2(g)===4NO(g)+6H2O(g);ΔH=-1 025 kJ/mol,该反应是一个
可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
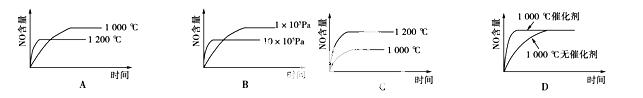
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)  B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
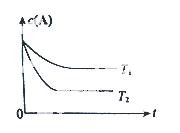 (1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于” 或“等于”)
(1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。
③反应在0~5min区间的平均反应速率v(A)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol∙L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:__ __________
__________
②设计实验方案:在不同H2O2浓度下,测定 ____________________________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。
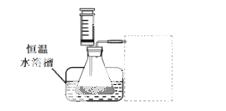
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。
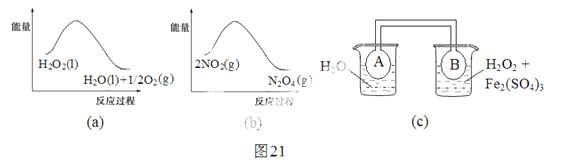
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验能达到预期目的的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 将SO2通入酸性KMnO4溶液中 | 证明SO2的水溶液具有弱酸性 |
| B | 向少量火柴头的浸泡液中滴加AgNO3、稀HNO3和NaNO2 | 验证火柴头含有氯元素 |
| C | 在淀粉-KI溶液中滴加少量市售食盐配制的溶液 | 真假碘盐的鉴别 |
| D | 在少量Fe(NO3)2试样加水溶解的溶液中,滴加稀H2SO4酸化,再滴加KSCN溶液 | 检验Fe(NO3)2试样是否变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究。
[实验一]探究浓硫酸的氧化性,将实验室常用的药品放入如图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
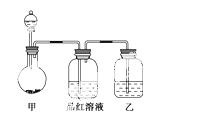
(1)该装置设计上存在明显缺陷,请指出:_______________________________。
(2)写出装置甲中反应的化学方程式:______________________________
__________________。装置乙中的试剂是:_______________________。
[实验二]探究某硫酸亚铁盐固体是否变质
(3)请你帮助小明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
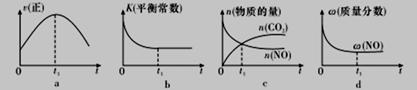
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂表面积(S)和时间(I)的变化曲线如图所示。

据此判断:
①该反应的△H_____________0(填“>”或“<”)。
②在T2温度下,0-2s内的平均反应速率v(N2) =____________mol/(L·s)。
③当固体催化剂的质量一定时,增大其表面积可增大化学反应速率。若催化剂的表面积S1>S2,在答题卡相应图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
2NO2(g)=N2O4(g) △H=-867kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式:_____________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应为_________________。
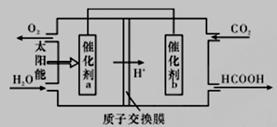
③常温下0. 1 mol/L的HCOONa溶液pH为10,则HCOOH的电离常数Ka =_______________mol·L-1(填写最终计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列叙述中不正确的是:
A.常温常压下,1mol甲基(-CH3)含有的电子数为9NA
B.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后胶体粒子的数目小于NA
C.标况下,2.24LHF中含有的电子数为NA
D.1 mol 金刚砂(SiC)中含有4NA碳硅键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子反应方程书写正确的是 ( )
A. H2O + H2O 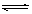 H3O+ + OH— B. CO32—+ 2H2O
H3O+ + OH— B. CO32—+ 2H2O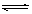 H2CO3 + 2OH—
H2CO3 + 2OH—
C. Ca(OH)2 + 2H+ 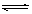 Ca2+ + 2H2O D. Al3++3H2O == Al(OH)3↓ + 3H+
Ca2+ + 2H2O D. Al3++3H2O == Al(OH)3↓ + 3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com