
分析 已知①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol、②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,依据盖斯定律①-$\frac{1}{2}$②可得目标反应C(s)+0.5O2(g)=CO(g,据此计算出a即可.
解答 解:已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,
根据盖斯定律,①-$\frac{1}{2}$②可得热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO (g)△H3=-110.5kJ/mol,则a=-110.5,
故答案为:-110.5.
点评 本题考查了盖斯定律的内容及应用方法,题目难度不大,根据盖斯定律得出已知反应与目标反应的关系为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何温度下反应均难以自发进行 | B. | 任何温度下反应均可以自发进行 | ||
| C. | 仅常温下反应可以自发进行 | D. | 仅高温下反应可以自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
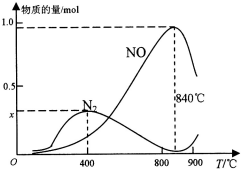 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
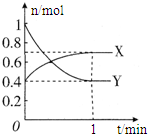 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为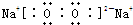 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| t/s | 0 | 50 | 150 | 250 | 350 |
| 总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用 1体积的乙醇与 3体积的浓 H2SO4混合加热到 140℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)制乙炔 | |
| D. | 以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性强弱关系:盐酸>石炭酸>碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入硫酸酸化的NaCl溶液,生成白色沉淀,证明原溶液中含Ag+ | |
| B. | 向溶液中加入稀盐酸,生成使澄清石灰水变浑浊的无色无味气体,则原溶液中含CO32- | |
| C. | 向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42- | |
| D. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②⑤ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com