
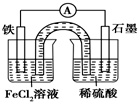
| A. | 原电池工作一段时间后,FeCl2溶液中c(Cl-)增大 | |
| B. | 此电池工作原理与硅太阳能电池工作原理相同 | |
| C. | Fe为正极,石墨上发生的反应为2H++2e-═H2↑ | |
| D. | 该装置中的盐桥完全可用金属导线代替 |
分析 铁为负极,被氧化,电极反应为Fe-2e-=Fe2+,石墨为正极,发生还原反应,电极反应为2H++2e-=H2↑,阴离子向负极移动,阳离子向正极移动,结合电极反应解答.
解答 解:A.Fe为负极,阴离子向负极移动,则FeCl2溶液中c(Cl-)会增大,故A正确;
B.硅太阳能电池是把太阳能转化为电能,该电池是化学能转化为电能,二者原理不同,故B错误;
C.Fe为负极,石墨为正极,正极上电极反应为2H++2e-=H2↑,故C错误;
D.若装置中的盐桥用金属丝如铁丝代替,右侧中金属Fe、石墨和稀硫酸溶液形成原电池,左侧为电解池,所以电流表指针有偏转,故D错误.
故选A.
点评 本题考查原电池知识,侧重于原电池的工作原理的考查,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )
用已知物质的量浓度的NaOH溶液测定某H2SO4溶液的浓度(H2SO4溶液放入锥形瓶中),图甲、乙是两只规格都为50mL的滴定管,下列有关该实验的说法正确的是( )| A. | 选用酚酞作指示剂的滴定终点的判断:当浅红色变为无色且半分钟内仍为无色时即为滴定终点 | |
| B. | 滴定终点读数时,俯视滴定管的刻度(其他操作均正确),会造成测定结果偏低 | |
| C. | 甲滴定管中盛有H2SO4溶液,液面恰好在10.00mL刻度处,并把甲滴定管中的H2SO4溶液全部放入烧杯中,其体积为40.00mL | |
| D. | 量取15.00mLKMnO4溶液应选择乙滴定管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ca2+、SO32-、ClO- | ||
| C. | Al3+、K+、OH-、NO3- | D. | Na+、Ca2+、SiO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
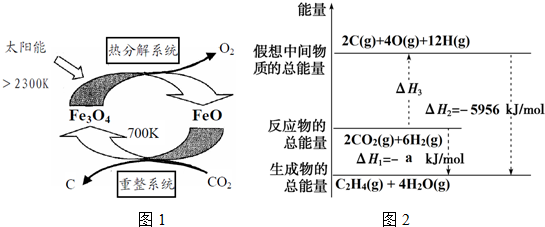
| 物质 | CO2(g) | C2H4(g) | H2O(g) |
| 能量/kJ•mol-1 | -394 | 52 | -242 |
| 化学键 | C=O | H-H | C=C | O-H |
| 键能/kJ•mol-1 | 803 | b | 615 | 463 |
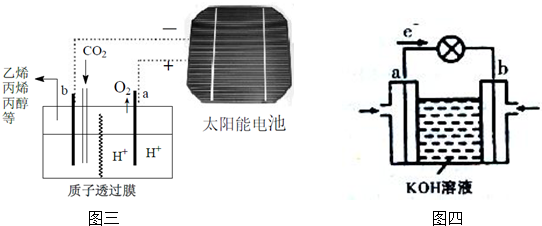
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
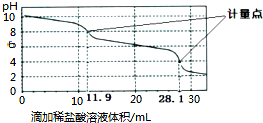
| A. | 上一计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| B. | 下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- | |
| C. | 此样品n(NaHCO3)=(28.1-2×11.9)×10-3mol | |
| D. | 使用该方法测定Na2CO3和NaOH混合物中氢氧化钠含量,将会得到1个计量点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
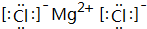 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com