
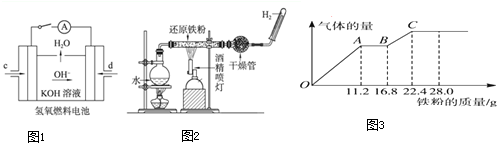
| 6 |
| 11 |
| ①-② |
| 2 |
| 571.2kJ/mol-226.2kJ/mol |
| 2 |
| 6 |
| 11 |
| 6 |
| 11 |
| 60mol |
| (5×4) |
| 22.4g |
| 56g/mol |
| 0.4mol |
| 0.2L |


科目:高中化学 来源: 题型:
| A、该电池正极反应式为:MnO2+H2O+e-=MnOOH+OH- |
| B、电池工作时负极pH一定降低 |
| C、用该电池作电源精炼铜,纯铜与锌连接 |
| D、用该电池作电源电解硫酸铜溶液,负极溶解6.5g锌,阴极一定析出6.4g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C、1 L 2 mol?L-1的FeBr2溶液中通入2.5 mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 |
| D、在H2C2O4中加入酸性KMnO4溶液:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNaOH的摩尔质量为40g |
| B、1mol 物质含有的微粒数就是6.02×1023 |
| C、1molN2的体积为22.4L |
| D、0.5molCO2约含有3.01×1023个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
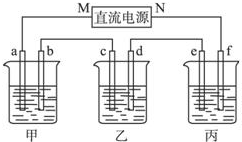 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④⑤⑥ | B、②④⑤⑥ |
| C、②④⑤ | D、②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
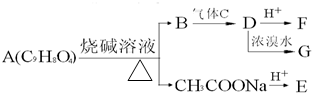 A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 水 |
| 酒化酶 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com